기사본문
AZ, ‘임핀지’ 두경부암 3상 “OS 개선 실패”
입력 2021-02-09 12:22 수정 2021-02-09 12:22
바이오스펙테이터 윤소영 기자

아스트라제네카(AstraZeneca)의 PD-L1 항체 ‘임핀지(Imfinzi, durvalumab)’가 두경부 편평세포암(Heand and Neck Squamous Cell Carcinoma, HNSCC)에서 표준 치료법 대비 전체생존율(Overall Survival, OS)를 개선시키지 못하면서 임상의 1차 종결점을 만족시키지 못했다.
아스트라제네카는 5일(현지시간) PD-L1이 높은 수준으로 발현되는 재발성 혹은 전이성 HNSCC에 대한 임상 3상 결과를 발표했다.
임상에 참여한 환자들은 최장 2년동안 임핀지 혹은 임핀지+트레멜리무맙(Tremelimumab) 혹은 화학요법+세툭시맙(Cetuximab)을 1차 치료제로 투약받았다(NCT02551159). 트레멜리무맙은 CTLA-4 항체이며 화학요법+세툭시맙은 현재 재발성/전이성 HNSCC의 표준 치료제로 사용되고 있는 치료법이다.
아스트라제네카는 임상 결과 임핀지 단독요법과 임핀지+트레멜미무맙 병용요법군에서 모두 화학요법+세툭시맙보다 좋은 OS를 나타내지 못해 1차 및 2차 종결점을 충족시키지 못했다고 발표했다. 안전성 및 내약성은 임핀지 단독요법과 병용요법군 모두에서 기존 임상 결과와 비슷하게 나왔다고 덧붙였다.
데이브 프레드릭슨(Dave Fredrickson) 아스트라제네카 항암제 사업부문 부사장은 “전이성 두경부암은 예후가 좋지 않은 치료가 어려운 병”이라며 “임상 결과는 실망스러웠지만 이번 임상으로 면역치료제 적용에 대한 이해를 넓힐 수 있었다”고 말했다.
임핀지는 PD-L1에 결합해 암세포의 면역회피 전략을 방해하는 면역관문억제 단일클론 항체(monoclonal antibody)다. 임핀지는 절제 불가능한 3기 비소세포폐암(NSCLC) 치료제로 미국, 유럽, 일본, 중국을 비롯한 많은 나라에서 시판되고 있다. 또한 임핀지는 확장기(extensive stage)의 소세포폐암 치료제, 진행성 방광암 치료제로 미국을 비롯한 다양한 나라에서 시판 승인을 받아 사용되고 있다.
아스트라제네카는 현재 임핀지 단독요법 혹은 병용요법으로 비소세포폐암, 소세포폐암, 방광암, 간암, 담도암(biliary tract cancer), 식도암(oesophageal cancer), 위암 및 위식도암(gastric and gastroesophageal cancer), 자궁경부암(cervical cancer), 난소암(ovarian cancer), 자궁내막암(endometrial cancer) 등 다양한 고형암 임상을 진행하고 있기도 하다.
아스트라제네카가 발표한 실적보고서에 따르면 2020년의 3분기까지 임핀지 매출은 14억8700만달러다. 이는 아스트라제네카의 항암제 파이프라인에서 31억7100만달러의 매출을 낸 타그리소(Tagrisso, osimertinib)에 이은 두번째 규모의 매출액에 해당한다. 임핀지는 2020년 3분기에만 5억3300만달러의 매출을 냈으며 매년 꾸준히 적응증을 넓혀가며 매출도 높이고 있다.
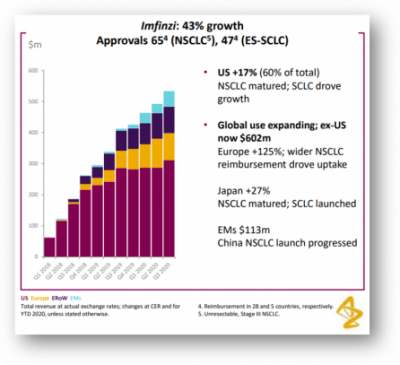
▲임핀지(Imfinzi, durvalumab) 2020 3분기 실적 (아스트라제네카 홈페이지)







