기사본문
식약처, SMA 유전자치료제 '졸겐스마' 국내 허가
입력 2021-05-28 14:38 수정 2021-05-28 14:51
바이오스펙테이터 윤소영 기자

▲졸겐스마(졸겐스마 홈페이지)
식품의약품안전처는 28일 노바티스(Novartis)의 ‘졸겐스마(Zolgensma, onasemnogene abeparvovec-xioi)’를 국내 첨단바이오의약품으로 허가했다고 밝혔다.
졸겐스마는 단회 정맥투여 ‘척수성 근위축증(Spinal Muscular Atrophy, SMA)’ 유전자치료제다. SMA는 생존운동뉴런1(SMN1) 유전자의 돌연변이로 SMN1 단백질이 정상 기능을 하지 못해 발생하는 질환이다. 졸겐스마는 SMN1 유전자에 이중대립형질 돌연변이가 있는 SMA 환자 중 ▲제1형 척수성 근위축증 임상적 진단이 있거나 ▲생존운동뉴런2(SMN2) 유전자의 복제수가 3개 이하인 경우에 사용되도록 허가받았다.
이번 허가로 졸겐스마는 첨단재생바이오법 시행 이후 2번째로 국내 허가된 첨단바이오의약품이 됐다. 1호 첨단바이오의약품은 지난 3월 국내 허가받은 노바티스의 CAR-T 치료제 ‘킴리아(Kymriah, Tisagenlecleucel)'다.
킴리아는 국내 허가 당시 5억원에 달하는 치료 비용으로 이슈가 됐었다. 졸겐스마는 현재 미국에서 킴리아보다 더 비싼 치료제로 판매되고 있어 졸겐스마 역시 약가 이슈가 있을 것으로 보인다. 미국에서 킴리아는 47만5000달러(약 5억2950만원), 졸겐스마는 212만5000달러(약 23억6890만원)에 시판되고 있다. 졸겐스마의 국내 약가는 아직 정해지지 않았다.
조쉬 베누고팔(Joshi Venugopal) 한국노바티스 대표는 “졸겐스마가 SMA의 근본 원인을 치료할 수 있는 최초이자 유일한 유전자 대체 치료제”라며 “우리는 지속적으로 국내 SMA 환자를 위한 혁신적인 치료 환경 개선에 최선을 다할 것이며, 더 많은 환자들이 졸겐스마 치료를 하루 빨리 받을 수 있도록 접근성 강화에도 쉼 없이 노력할 것이다”고 말했다.
SNM 단백질은 뇌와 척수에서 발생한 운동 자극을 근육에 전달하는 신경세포 유지에 핵심 역할을 한다. 때문에 SNM 단백질이 기능을 하지 못하면 근육이 약해져 식사와 움직임뿐만 아니라 자가 호흡도 어려워지면서 생명까지 위협할 수 있다. SMA는 전세계적으로 신생아 약 1만명당 1명 꼴로 발생한다. SMA 환자의 약 60%는 심각한 유형인 제1형 SMA로, 치료받지 않으면 2세 전에 약 90%의 환자가 사망한다고 알려져 있다.
졸겐스마는 정상 기능을 하는 사람생존운동뉴런(hSMN) 유전자가 도입된 재조합 AAV 벡터(adeno-associated viral vector) 기반의 치료제다. 졸겐스마를 투여받은 환자들은 중추신경계의 운동 신경세포에서 정상 SMN 단백질이 발현될 수 있다. 유전자치료제기 때문에 평생 1번의 투약으로 지속적인 치료효과를 기대할 수 있다. 또한 6년 이상의 장기 안전성 및 유효성 데이터를 보유하고 있다는 한국 노바티스측의 설명이다.
졸겐스마는 첨단재생바이오법 제30조에 따른 ‘장기추적조사’ 대상 의약품으로 투여일로부터 15년간 이상사례 등을 추적해야 하며, 처음 판매한 날부터 1년마다 장기추적조사 한 내용과 결과 등을 식약처에 보고하도록 되어 있다.
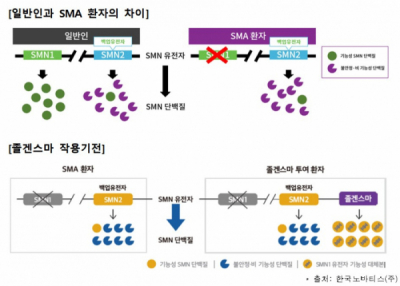
▲졸겐스마 작용 기전(식약처 제공)







