기사본문
파바리스, ‘브라디키닌 B2 길항제’ HAE “FDA 임상중단"
입력 2022-08-25 08:44 수정 2022-08-25 08:44
바이오스펙테이터 서윤석 기자

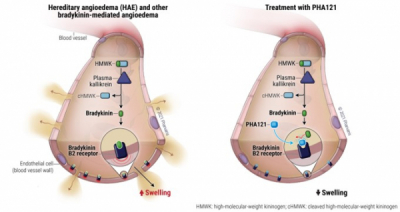
스위스 파바리스(Pharvaris)의 경구용 브라디키닌 B2수용체(bradykinin-B2-receptor) 길항제 'PHA121'의 유전성혈관부종(hereditary angioedema, HAE) 임상에 제동이 걸렸다. 미국 식품의약국(FDA)이 PHA121의 전임상 데이터를 분석한 뒤 임상중단(clinical hold)을 요청했기 때문이다.
PHA121은 경구용 약물로 기존 치료제들이 피하주사(SC) 제형인 것과 차별점을 가진다. 현재 HAE 발작예방 치료제로는 피하주사(SC) 제형인 다케다(Takeda)의 ‘타크자이로(Takhzyro, lanadelumab)’, '피라지르(Firazyr, icatibant)', CSL의 '해가르다(Haegarda, C1 esterase inhibitor)’ 등이 시판 중이다.
파바리스는 22일(현지시간) 미국 FDA로부터 유전성혈관부종(HAE) 치료제 후보물질 ‘PHA121’의 미국내 임상 2건에 대해 임상중단(clinical hold)을 요청받았다고 발표했다. 이 소식이 알려진 후 파바리스의 주가는 전일 종가대비 34.32% 하락한 12.14달러로 마감했다.
임상정보사이트 Clinicaltrials.gov에 따르면 파바리스는 현재 PHA121의 소프트젤 캡슐(softgel capsule) 제형 ‘PHVS416'의 HAE 치료, 예방 임상2상을 각각 진행하고 있다.
발표에 따르면 FDA는 PHA121의 전임상 데이터를 검토 후 구두(verbally)로 임상중단 소식을 알렸으며, 30일 내에 공식적인 임상중단 서한(clinical hold letter)을 파바리스에 보낼 예정이다.
파바리스는 임상중단에 대한 구체적인 원인을 공개하지 않았지만, FDA와 논의 후 추가 상황을 업데이트할 계획이라고 설명했다.
베른트 모디그(Berndt Modig) 파바리스 CEO는 “FDA와 긴밀히 협력해 문제점을 해결하기 위해 최선을 다하고 있다”며 “HAE를 위한 새로운 치료옵션을 제공하기 위해 노력할 것”이라고 말했다.
HAE은 희귀 상염색제 우성 유전질환으로 팔, 다리, 얼굴 등의 부위가 부어오르는 HAE 발작 증상을 나타낸다. HAE 발작은 갑작스럽게 발생해 급격하게 진행되기 때문에 HAE 환자들 대부분은 예방치료제를 사용한다.
HAE 발작은 SERPING1(serpin family G member1) 유전자 돌연변이에 의한 C1 저해제(C1-INH)의 부족 또는 비정상적인 활성으로 발생한다고 알려져 있다. C1 저해제가 정상적인 기능을 못하게 되면 프리칼리크레인/칼리크레인(Prekallikrein/kallikrein)이 브라디키닌을 활성화시켜 모세혈관 혈장 누출을 유도해 혈관부종이 발생한다.
한편 파바리스는 지난해 2월 미국 나스닥 시장에 상장한 스위스 기업으로 지난 2015년 설립됐다. 파바리스는 현재 미국과 네덜란드에 지사를 두고 있다.