기사본문
한미, 얀센 수출 신약 두번째 임상 본궤도..다른 제품은?
입력 2017-09-11 06:59 수정 2017-09-11 07:10
바이오스펙테이터 천승현 기자
한미약품이 얀센에 기술수출한 비만당뇨치료제가 지난해 말 임상시험이 중단된지 9개월만에 새로운 디자인의 임상시험을 본격 착수한다. 미국 식품의약품국(FDA)에 임상시험 계획 신청, 승인에 이어 환자모집을 시작하며 '생산 지연 이슈'에서 벗어날 조짐이다. 지난해 제넨텍에 기술수출한 항암제는 단독 요법과 병용요법 2개의 임상시험이 순조롭게 진행 중이고, 사노피에 기술수출한 당뇨약도 4분기 임상시험 착수가 예고되는 등 지난해 임상중단으로 불거진 불확실성이 해소되는 분위기다.
11일 국제 임상시험 등록사이트 ‘Clinical Trials'에 따르면 얀센은 최근 ’JNJ-64565111‘(한미 과제명 HM12525A)의 임상1상시험을 위한 환자 모집(Recruiting)을 시작했다. 제2형 당뇨병 환자에서 JNJ-64565111의 안전성, 내약성, 약물 동력학 및 약력학 평가를 위한 임상 1상시험이다. 지난 6월 FDA에 신청한 임상시험 계획을 7월말에 승인받은데 이어 지난달 26일 환자모집 단계에 진입했다.

▲얀센은 최근 국제 임상시험 등록사이트 ‘Clinical Trials'에 JNJ-64565111의 임상1상시험의 환자 모집(Recruiting)을 시작했다. 기존에 진행하던 임상시험은 조기 종료(Terminated) 됐다.
JNJ-64565111은 지난 2015년 12월 한미약품이 얀센에 임상1상시험을 완료하고 기술수출한 약물이다. 한미약품이 보유한 약효지속 기반기술 랩스커버리(LAPSCOVERY)를 적용한 바이오신약이다.
당초 얀센은 JNJ-64565111의 기술을 넘겨받은 이후 추가 임상1상시험을 진행하다 지난해 11월 임상시험용 의약품 공급이 차질이 생기자 임상시험을 중단했다. 당시 해당 임상시험의 진행 단계를 '환자모집'(recruiting)에서 '환자모집 유예'(suspended participant recruitment)으로 변경했다. 이 임상시험은 최종적으로 조기 종료(Terminated)됐다.

▲한미약품 연구센터 전경
최근 한미약품으로부터 임상용 의약품 공급을 확인하고 새로운 임상1상을 다시 시작하면서 임상 중단 이후 약 9개월만에 임상이 본 궤도에 진입한 셈이다.
JNJ-64565111의 임상재개는 그동안 한미약품 기술수출 약물의 불확실성을 노출했던 ‘생산 문제’가 소멸됐음을 의미한다.
사실 한미약품은 지난해 베링거인겔하임으로부터 권리가 반환된 ‘올무티닙’ 이외에도 랩스커버리 적용 약물의 생산이 차질을 빚으면서 불안감이 증폭됐다. 랩스커버리는 바이오의약품의 짧은 반감기를 늘려주는 플랫폼 기술로 투여 횟수 및 투여량을 감소시켜 부작용은 줄이고 효능은 개선하는 기술이다.
한미약품은 랩스커버리 적용 약물 4개를 기술수출했다. 임상시험 재개가 예고된 JNJ-64565111 이외에 사노피와 총 39억 유로(약 4조9000억원) 규모의 기술수출 계약을 맺은 퀀텀프로젝트(에페글레나타이드, 지속형인슐린, 지속형인슐린콤보)도 랩스커버리 기술이 적용됐다.
랩스커버리 적용 약물이 기술수출 이후 불안한 행보를 보였다. 에페글레나타이드는 지난해 하반기 임상3상시험 착수 예정이었지만 생산 지연으로 임상 일정이 미뤄졌다. 사노피는 지난해 말 지속형인슐린의 권리를 반환했고, 지속형인슐린콤보는 일정기간 한미약품의 책임으로 개발한 이후 사노피가 이를 인수하는 ‘조건부 기술이전’으로 계약 내용이 변경됐다.
사노피는 지난 7월말 2분기 실적을 발표하면서 오는 4분기 에페글레나타이드의 임상 3상을 착수하겠다는 계획을 공개했다. 지난해 ‘생산지연 이슈’로 임상시험이 중단된 2개의 신약 과제 중 JNJ-64565111는 임상이 재개됐고 에페글레나타이드는 임상시험 재개가 예고된 셈이다.
한미약품 관계자는 “랩스커버리 적용 약물의 생산 과정에서 안전성과 유효성과 상관없는 일시적인 문제로 생산이 중단됐고 최근 관련 문제가 모두 해결됐다고 보면 된다”라고 설명했다. 한미약품이 지난해 4월부터 총 2573억원을 투자해 건설 중인 바이오플랜트 제2공장은 현재 준공을 앞두고 있다.
2015년부터 한미약품이 기술수출한 신약 중 권리반환된 2개(베링거인겔하임 ‘올무티닙’, 사노피 ‘지속형인슐린콤보’)를 제외하고는 현재까지는 큰 차질 없이 후속 개발단계가 진행 중이다.
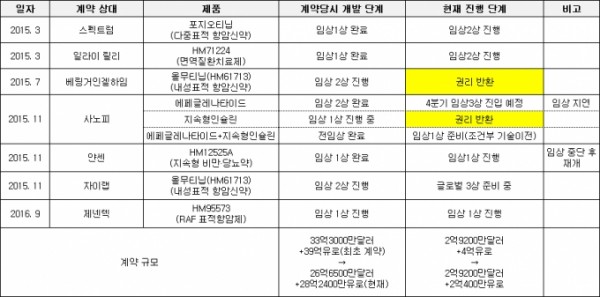
▲한미약품 주요 기술수출 신약 개발 진행 현황
한미약품이 지난해 9월 제넨텍에 기술수출한 RAF 표적항암제 ‘HM95573'의 경우 올해 2건의 새로운 임상시험에 돌입했다.
한미약품은 지난 2월 BRAF, KRAS 또는 NRAS 유전자 변이 고형암 환자에서 HM95573 단독치료의 유효성 탐색 및 안전성 평가를 위한 임상1상시험을 시작했다. 지난달에는 국소 진행성 또는 전이성 고형암 환자를 대상으로 ’코비메티닙‘과 HM95573의 안전성, 내약성, 약동학을 평가하는 임상1상시험에 착수했다.
베링거인겔하임이 반환한 항암제 ‘올무티닙’의 경우 최근 중국 시장 진출 계획에는 다소 변화가 생겼다. 중국제약사 자이랩이 올무티닙의 중국 판권을 보유 중인데, 당초 자이랩이 독자적으로 임상1상시험을 진행키로 했지만 최근 한미약품과 자이랩간의 협의 하에 글로벌 임상3상에 중국을 포함하는 방향으로 임상시험 계획을 변경했다. 중국 임상1·2상을 생략하고 임상3상을 진행하면서 전체 임상시험 기간은 단축될 것으로 한미약품 측은 전망했다.
2015년 9월 일라이릴리에 기술 수출된 자가면역질환 치료제 ‘HM71224'(릴리 과제명 LY3337641)는 지난해 9월 글로벌 임상2상시험 단계에 진입했다. 한미약품이 2015년 3월 미국 제약사 스펙트럼에 기술수출한 항암신약 ‘포지오티닙’은 지난 3월 미국 임상2상시험을 시작했다. 스펙트럼은 지난 4월 포지오티닙의 적응증을 기존 유방암에서 비소세포폐암으로 확대하는 임상시험을 시작했다.
한미약품은 올해 상반기에만 336억원의 기술료 수익을 올렸다. 사노피와의 기술이전 계약 수정으로 상반기에만 300억원 이상의 기술료 수익의 공백이 발생했지만 제넨텍의 계약금 분할 인식 등으로 추가 기술료가 반영됐다. 한미약품이 2015년부터 거둔 누적 기술수출 수익은 5738억원에 이른다.







