기사본문
FDA “2021년 세포∙유전자치료제 IND filing 4배↑ 전망"
입력 2018-11-27 07:11 수정 2018-12-06 12:38
바이오스펙테이터 서일 기자

"유전자를 전달할 수 있는 벡터 시스템이 발전하면서 유전자치료 시장 규모는 증가하고 있으며 희귀질환 치료의 새로운 가능성을 열고 있다"
스콧 고틀립(Scott Gottlieb) 미국 식품의약국(FDA) 국장은 지난 16일 유전자 치료제 검토 비용에 관한 투자를 늘릴 계획이라며 이와 같이 말했다.
고틀립 국장은 "유전자치료 관련 임상시험을 검토하는 비용을 늘릴 방법에 대한 내부 회의를 진행하고 있다"며 "5000만달러 예산을 투입하여 60명의 검토 전문가를 추가로 영입할 예정"이라고 밝혔다.
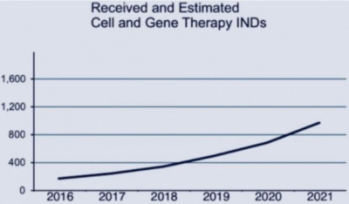
FDA는 올해 250건의 세포∙유전자 치료제의 임상승인신청서가 제출(IND filing)될 것으로 예상하고 있다. 이 가운데 100건이 유전자치료제 임상시험신청서였다. FDA는 2021년에는 1000건 이상의 세포∙유전자 치료제 임상승인신청서가 제출될 것으로 내다봤다. 즉 3년 사이에 임상승인 신청이 4배 증가할 것으로 전망한 것이다.
FDA는 올해 유전자 치료제 개발을 빠르게 하기 위한 제도적 기반을 마련하고 있다. 지난 4월 유전자 치료제 개발과 제조에 관한 지침 6개를 업데이트 했으며, 지난 8월에는 40년간 운영되던 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee, RAC)의 검토 프로세스를 간소화한다고 발표했다.
FDA는 2017년 3개의 유전자 치료제의 판매를 승인했다. 유전자 치료에 대한 임상 시험은 1990년에 시작되어 2017년에 판매 승인을 받기 시작했다.
희귀질환 치료제로 스파크 테라퓨틱스(Spark Therapeutics)가 개발한 럭스터나(Luxturna)는 RPE65 유전자 돌연변이로 인한 망막질환을 치료하는 약물로 체내에 직접 투여하는 유전자 치료제다.
항암제 분야에서는 환자에게서 추출한 T세포를 유전적으로 변형한 후 다시 주입하는 CAR-T 치료제로 노바티스(Novartis)의 킴리아(Kymria)와 길리어드사이언스(Gilead Science)의 예스카르타(Yescarta)가 승인받았다. 킴리아는 25세 이하 재발성 급성 림프구성 백혈병 환자 대상 치료제로 승인받았으며, 예스카르타는 비호지킨성 림프종 환자 대상 치료제로 승인받았다.







