기사본문
젠코의 CD123xCD3 이중항체 '임상보류'.."부작용 우려"
입력 2019-02-22 08:42 수정 2019-02-23 07:57
바이오스펙테이터 김성민 기자
젠코(Xencor)는 혈액암 치료제로 개발하는 CD123xCD3 이중항체 'XmAb14045'에 대해 미국 식품의약국(FDA)으로부터 부분 임상보류(partial clinical hold) 조치를 받았다고 지난 20일 밝혔다. 젠코는 부분 임상보류가 해제될 때까지 새로운 환자를 등록할 수 없다. 이 약물은 노바티스와 공동 개발 파트너십을 맺은 이중항체이기도 하다.
젠코는 급성골수성백혈병(acute myeloid leukemia, AML) 환자에게 XmAb14045를 투여하는 임상 1상을 진행하고 있다(NCT02730312). FDA는 임상 도중에 2명의 환자가 사망한 케이스가 약물 관련 부작용일 가능성이 있다고 판단해 이번 결정을 내렸다. 첫번째 케이스는 약물을 첫 투약하고 환자에게서 사이토카인신드롬(cytokine release syndrome, CRS)이 발생했는데, 환자가 자진해 임상 참여를 중단하겠다고 결정한 경우라고 밝혔다. 두번째 케이스는 몇차례 약물 투약을 한 다음 폐에 체액이 쌓여 호흡곤란이 오는 급성폐부종(acute pulmonary edem)이 발생했다.
젠코는 FDA에 환자 사망건에 대한 자세한 정보, 안전성과 효능 데이터를 제출하고 스터디 프로토콜을 수정해 제출해야 한다. 바실 다흐야(Bassil Dahiyat) 젠코 대표는 "이번 임상보류를 해결하기 위해 FDA와 긴밀하게 협력하고, 환자 모집을 재개하기 위한 업데이트 정보를 제공할 것"이라며 "현재 임상 1상을 진행하고 있는 다른 CD3 이중항체인 XmAb13676(CD20xCD3)와 XmAb18087(SSTR2xCD3)는 이번 결정에 영향을 받지않는다"고 밝혔다.
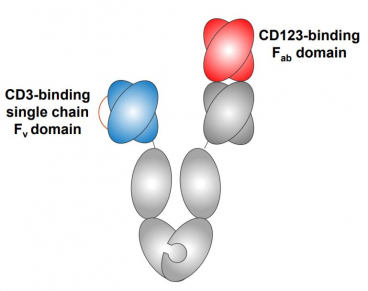
약물 부작용 우려를 낳은 XmAb14045는 CD3 결합 scFv과 CD123 결합 Fab로 디자인한 이중항체다. Fc 매개 면역반응을 낮추고, 반감기는 원래 항체와 유사한 형태다. 약물이 겨냥하는 CD123(IL-3 receptor α-subunit)는 초기 단계의 조혈전구세포와 호염구(basophil)가 발현하며, 다양한 타입의 악성 혈액암 세포에서 발현이 높다. XmAb14045는 T세포가 발현하는 CD3와 CD123에 동시에 결합해, T세포가 CD123 발현 세포를 공격해 사멸시키는 메커니즘이다.... <계속>







