기사본문
한미 pan-RAF저해제 1상 "NRAS·KRAS변이 암 부분관해"
입력 2019-06-05 08:04 수정 2019-06-05 08:08
바이오스펙테이터 시카고(미국)=조정민 기자

▲한미약품 '2019 ASCO' 구두발표 현장.
“벨바라페닙(belvarafenib)은 진행성 고형암 환자를 대상으로 진행한 임상1상에서 뛰어난 내약성과 함께 항암효과를 보였다. 특히 NRAS 변이를 가진 흑색종 환자의 경우 최고 전체반응률(bORR)이 44.4%였으며 24.9주에 달하는 무진행생존기간이 확인됐다.”
3일(현지시간), 미국 시카고에서 개최되는 ‘2019 미국임상종양학회(2019 ASCO)’ 연례행사에서 한미약품의 차세대 pan-RAF 저해제 ‘벨바라페닙’의 임상1상 데이터가 공개됐다. 김태원 서울아산병원 종양내과 교수는 구두발표를 통해 벨바라페닙의 임상1상 내용과 그 결과에 대해 발표했다.
RAF와 RAS는 세포의 증식과 생존을 조절하는 미토겐 활성화 단백질 키나아제(Mitogen-activated protein kinase; MAPK)의 주요 구성요소로 ARAF, BRAF, CRAF와 HRAS, NRAS, KRAS 등 각각 3가지 아형(subtype)이 존재한다. RAF와 RAS의 돌연변이는 여러 고형암의 유발요인으로 알려졌다.
벨바라페닙은 MAPK 신호체계의 다양한 변이타입을 조절, 활성을 차단하는 경구용 표적항암제다. 김 교수는 “벨바라페닙은 높은 선택성을 가진 pan-RAF 억제제로 다양한 고형암에서 치료효과가 기대되는 약물”이라고 소개하면서 환자유래종양이식모델 등을 이용한 전임상에서 벨바라페닙이 BRAF, KRAS, NRAS 변이 종양의 성장을 효과적으로 억제했다고 밝혔다.
한미약품은 전임상 결과를 토대로 BRAF, KRAS, NRAS 변이를 가진 진행성 고형암 환자에서 벨바라페닙의 안전성과 효능을 확인하기 위한 임상1상을 설계, 진행했다. 임상1상은 용량증가(dose escalation)의 ‘RAFI-101’과 용량확장(dose expansion)의 ‘RAFI-102’로 나눠 설계됐다.
RAFI-101의 경우 안전성과 내약성, 최대내약용량(MTD) 및 임상2상 적용용량(RP2D) 확인이 일차평가점이었으며 그외에도 전체생존율(ORR), 무진행생존기간(PFS), 최대종양감소(MTS) 등이 평가요소로 설정됐다. 2018년 5월까지 총 72명이 임상에 참여했으며 참여자들은 총 7개의 코호트로 분류돼 각각의 용량을 적용받았다.
김 교수는 “RAFI-101 용량증량시험에서 확인한 결과, 450mg 하루 2회 복용이 적정용량인 것으로 나타났다. 따라서 용량확장시험인 RAFI-102는 변이 발생 암종에 따라 63명의 환자를 6개의 군으로 분류하고 450mg의 벨바라페닙을 일 2회 적용한 뒤 항종양효과와 안전성 등을 확인했다”고 설명했다.
임상에 참여한 환자의 특성을 분석했을 때, 두 임상 모두 대장직장암(Colorectal cancer; CRC)과 흑생종(melanoma)를 가진 대상자가 주를 이뤘고 그 밖의 질환으로는 비소세포폐암, 위장관기질종양(Gastrointestinal stromal tumor; GIST), 육종 등이 있었다.
발표에 따르면 RAFI-101 시험에 참여한 67명 가운데 7명(10.5%)에서 부분관해(PR)가 관찰됐는데 그 중에서도 NRAS 변이 흑색종 환자의 경우 44.4%(4명/9명)에서 부분관해가 있는 것으로 나타났다. 용량확장시험인 RAFI-102에서도 57명 중 11.9%에 해당하는 7명에서 부분관해 반응이 발생했다.
김 교수는 “RAFI-101에서 30%이상 종양이 감소한 부분관해 반응을 보인 대상자 중에는 흑색종이 가장 많았으며, 가장 많이 종양이 줄어든 환자는 하루 2회 450mg을 투여받은 KRAS G12V 변이 육종 환자로 50%의 변화를 보였다”고 말했다.
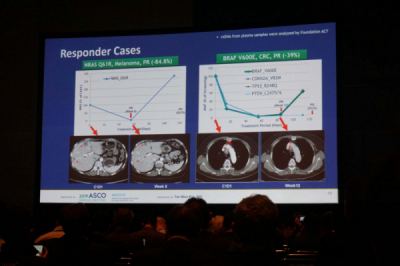
▲벨바라페닙 용량확장시험에서의 부분관해 사례.
RAF-102에서는 4명의 흑색종환자와 2명의 대장암, 1명의 방광암 환자에서 부분관해가 관찰됐다. 이날 발표에서 2건의 환자의 치료반응이 사례로 소개됐는데 그 중 NRAS Q61R 변이의 흑색종 환자의 경우 치료 시작 후 8주 뒤 종양의 크기가 84.8% 감소한 것으로 나타났다.
발표자인 김태원 교수는 “참여자 135명의 안전성 데이터 분석 결과, 3등급 이상의 이상반응 발생율은 33.3%(45명)였으며 그 중 약물과 관련된 부작용 발생은 19.3%(26명)로 관찰됐다. 가장 흔한 치료 관련 부작용은 발적과 여드름성 피부염, 발열 등이다”고 밝혔다.
김 교수는 “이번 임상1상을 통해 벨바라페닙이 우수한 안전성과 내약성을 가진 것을 확인했으며 BRAF, KRAS, NRAS 유전자 변이를 가진 고형암 환자에서 항종양 효과를 보이는 것을 관찰했다. 특히 NRAS 변이 흑색종에서의 결과가 고무적이다”고 말했다.
한편, 벨바라페닙은 2016년 제넨텍에 총 8억3000만달러 규모로 기술이전됐다. 한미약품은 이번에 발표한 단독요법 임상 이외에 벨바라페닙과 제넨텍의 MEK 저해제 코비메티닙의 병용 임상1상 등을 활발하게 진행하고 있다.







