기사본문
[남궁석의 신약연구史]엔도 아카리 연구와 '스타틴'
입력 2018-11-07 09:24 수정 2018-11-07 09:24
남궁석 SLMS 대표
이번 연재에서는 혈중 LDL 수준을 낮추는데 현격한 기여를 한 콜레스테롤 생합성 저해제인 스타틴(Statin)의 발견 과정을 엔도 아키라(Endo Akira, 1933- )의 연구의 궤적을 중심으로 하여 알아보도록 하자.
엔도 아키라
엔도 아키라(遠藤 章, 1933-)는 1933년 일본 도호쿠 지방의 아키타에서 태어나 도호쿠 대학 농학부에 입학하였다. 그는 곰팡이 페니실륨(Penicillum)에서 유래된 항생제 페니실린의 발견에 매혹되어 자연물에서 생리활성을 갖는 물질의 발견에 관심을 갖게 되었다. 비단 엔도뿐만 아니라 2차대전 이후 일본의 대학과 산업계에서는 항생물질 등의 유용 생리활성을 가지는 물질을 미생물에서 발굴하는 연구가 활발히 진행되었다. 엔도는 1957년 대학을 졸업한 후 산쿄제약(현재의 다이이치-산쿄)에 입사하여 응용미생물 관련 연구를 하는 부서에 배속되었다. 엔도가 최초로 수행한 연구는 와인이나 사과주에 함유되어 이를 불투명하게 하는 성분인 펙틴(Pectin)을 분해하여 와인의 질을 높일 수 있는 효소인 펙틴 분해효소를 포도 유래의 곰팡이에서 분리하는 것이었다. 그는 펙틴 분해효소를 생산하는 곰팡이를 분리하고, 이 효소의 특성을 파악하는 연구를 수행하였다. 그가 발견한 새로운 효소는 성공적으로 상업화되었다[1]
성공적으로 프로젝트를 수행하여 상업화에 기여한 공로로 엔도는 미국에서 2년 동안 연수할 수 있는 기회를 얻게 되었다. 이 시점에서 엔도는 콜레스테롤 생합성 과정에 흥미를 가지게 되어 콜레스테롤 생합성 경로를 처음 규명하여 노벨상을 수상한 콘라드 블로흐(Konrad E Bloch)의 연구실에서 연구를 수행하고 싶어했으나 해당 연구실의 정원이 다 차 그 뜻을 이루지 못했다. 그 대신 세균의 세포막에 존재하는 인지질의 생합성을 연구하는 연구자인 뉴욕의 알버트 아인슈타인 의대의 버나드 호레커(Bernard Horecker)의 연구실에서 1966년부터 1968년까지 2년간 연구를 하게 되었다.
그는 뉴욕에서 연구를 하는 동안, 미국의 비만 인구가 많다는 것에 주목했다. 특히 그가 거주하던 주변에서 심혈관 질환때문에 구급차로 병원에 후송되는 환자들을 자주 목격하면서 심혈관 질환의 심각성을 인식하게 되었다. 특히 이전 연재에서 기술한 것처럼 1960년대 미국의 심혈관 질환의 심각성은 급격히 사회문제되었으며, 엔도는 자신이 수행한 연구기술(미생물을 이용한 생리활성을 갖는 물질의 탐색)을 이용하여 이러한 문제를 해결할 수 있는 신물질을 만들 수 있을 것이라는 아이디어를 얻게 되었다.
엔도는 일본으로 돌아가서 회사에 복직한 후, 산쿄 연구소에서 원하는 연구를 수행할 수 있는 기회를 얻게 되었다. 그는 미국에서 얻은 아이디어를 통하여 콜레스테롤 생합성을 저해하는 화합물을 곰팡이유래에서 찾을 수 있을 것이라는 기대하에 실험을 수행하였다. 콜레스테롤은 미생물의 생존에 필수적이기 때문에 곰팡이는 미생물을 죽이기 위하여 콜레스테롤 생합성을 저해할 것이라는 가설이었다.
그는 동위원소로 표지된 아세트산을 래트의 간 유래 추출물에 처리하면 동위원소가 세포막에 들어간다는(아세트산은 콜레스테롤의 전구체로 작용하고, 콜레스테롤이 합성하면 세포막의 구성 성분이 되기 때문에) 기존의 실험 결과를 응용하여 이 과정을 억제하는 물질을 생산하는 미생물을 찾으려고 했다. 엔도의 연구팀은 수천 종류의 미생물을 배양하여 미생물 배양액을 간 유래 추출물에 처리하여 이 중에서 콜레스테롤 합성을 저해하는 화합물을 탐색했다.
이들은 1971년 프로젝트를 개시하여 수천 종의 곰팡이 유래의 추출물에서 콜레스테롤 합성을 저해하는 물질을 탐색하였다. 이들은 약 3,800종의 곰팡이 유래 추출물을 검사한 이후 콜레스테롤 합성을 저해하는 물질을 생산하는 곰팡이를 하나 발견하였다. 그러나 실망스럽게도 이 물질의 주 성분은 기존에 알려져 있던 물질인 시트리닌(Citrinin)이라는 물질임이 밝혀졌다[2]. 이 물질은 콜레스테롤의 합성의 주 조절단계인 HMG-CoA 환원효소(HMG-CoA reductase) 활성을 억제하였고, 래트에 투여하였을때 실제로 혈중 콜레스테롤 농도를 낮추는 것을 확인하였다. 그러나 이 물질은 신장에 독성을 보였고, 그 결과 이 물질의 개발은 중단되었다. 그러나 이 결과는 실제로 곰팡이에서 콜레스테롤 생합성을 억제하는 물질을 찾을 수 있다는 희망을 연구진에게 주었다.
컴팩틴(Compactin)의 발견
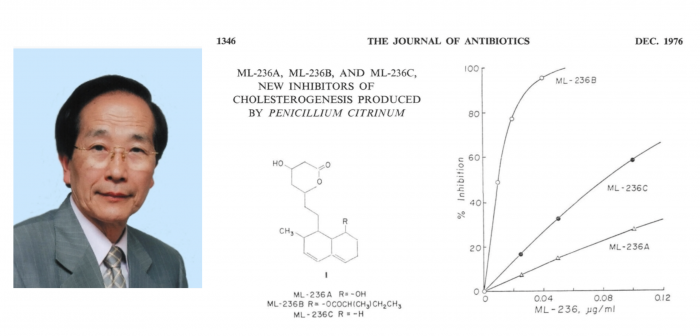
시트리닌(Citrinin)을 발견한 지 1년 후에, 이들은 Penicillum citrinum Pen-51이라는 이름의 균주에서 시트리닌과는 다른 활성 물질을 발견했다. 이 물질은 교토의 미곡상에서 얻은 쌀 유래의 곰팡이에서 나온 물질이었다. 해당 곰팡이는 콜레스테롤 합성을 저해하는 활성 물질을 생산하기는 했지만 매우 낮은 농도로 생산하여, 이를 실제 연구할 수준으로 확보하여 정제하는데까지는 1년 반 이상의 시간이 걸렸다. 콜레스테롤 합성을 저해하는 활성 물질은 ML-236A, ML-236B, ML-236C로 명명된 3종류의 물질이었으며, 이중 가장 활성이 좋은 물질은 ML-236B라는 물질이었고 이 3가지 물질은 기본적인 골격을 공유하고 있었다.
정제된 물질을 이용하여 실험해본 결과 이 물질은 콜레스테롤 합성의 주 조절단계인 HMG-CoA 환원효소를 억제하였고, 이 물질은 HMG-CoA 환원효소의 원래 기질인 HMG-CoA와 유사하게 생긴 물질로써, 원래의 기질보다 효소에 더 강하게 결합하여 효소의 활성을 방해하는 물질이었다. 이 물질은 10nM의 농도에서도 활성을 가지는 매우 활성 저해의 역가가 높은 물질이었다. 이 결과는 1976년 일본에서 발행되는 항생물질 관련 저널인 Journal of antibiotics을 통하여 최초로 발표되었다[3].
▲그림 1 : 스타틴 발견의 선구자인 엔도 아키라 (遠藤 章). 엔도는 곰팡이 페니실륨에서 콜레스테롤 합성의 핵심 단계인 HMG-CoA 환원효소를 억제하는 물질인 ML-236B를 분리하였으며, 이는 기존에 알려진 컴팩틴 (Compactin)과 동일한 물질이었음이 밝혀졌다.
흥미있는 것은 이들이 발견한 물질은 이미 이전에 영국의 제약회사인 비첨(Beecham, 현재는 여러번의 합병을 거쳐 갈락소-스미스클라인의 일부가 되었다)사에서 이전에 임질균 (Neisseria gonorrhea)에 대한 항생물질로 발견된 적이 있었던 물질이었고 이들에 의해서 컴팩틴(Compactin)이라는 이름이 붙여진 상태였다[4]. 그러나 비첨사에서는 컴팩틴이 임질균에 대한 활성이 기대에 미치지 못하자 더이상 연구를 하지 않았었다.
엔도와 산쿄사의 연구진들이 HMG-CoA 환원효소에 대한 강력한 저해물질을 찾았다는 소식은 당시에 LDL 리셉터와 HMG-CoA 환원효소에 대한 연구를 수행하던 미국 텍사스대의 브라운과 골드스타인에게도 들어갔다. 이들은 협력 연구를 제안하였고, 엔도의 연구팀이 제공한 ML-236B 를 세포에 처리하였다. 높은 농도의 ML-236B를 처리하자 예상대로 콜레스테롤의 생합성이 정지되었고, 세포의 성장 역시 멈췄다. 이 상태에서 HMG-CoA 환원효소의 산물인 메발론산(Mevalonate)를 첨가하자, 세포가 정상적으로 자라기 시작하였다. 이러한 결과는 ML-236B에 의한 콜레스테롤 합성 저해 현상은 메발론산을 형성하는 HMG-CoA 환원효소를 억제해서 생기는 현상이라는 것을 의미한다. 연구자들은 ML-236B를 처리한 세포를 파쇄하여 HMG-CoA환원효소의 활성을 측정해 보았다. 그 결과 매우 의외의 일이 일어났는데, 세포 파쇄물에서 HMG-CoA 환원효소의 활성이 매우 증가했다는 것이 밝혀졌다. 즉 세포는 HMG-CoA 환원효소가 억제되자 이를 보충하기 위해서 더 많은 양의 HMG-CoA 활성효소를 만들어 내려고 했던 것이다. 이렇게 증가된 HMG-CoA 환원효소는 세포 내에서는 ML-236B 에 의해서 저해되지만, 세포가 파쇄되어 ML-236B의 농도가 희석되어 낮아지자 이러한 저해가 해제되고 높은 효소 활성이 관찰된 것이다. 이러한 결과는 HMG-CoA 효소가 얼마나 만들어지느냐가 최종 산물인 콜레스테롤에 의해서 조절된다는 것을 의미한다. 이들의 결과는 1978년 JBC에 출판되었다[5].
래트에서 효과가 없던 컴팩틴, 그러나 실험 모델을 바꾸어 얻은 돌파구
산쿄사에서는 ML-236B(컴팩틴)을 분리하면서 곧바로 래트에 이를 처리하여 혈중 콜레스테롤 농도를 감소시키는지를 관찰하였다. 그러나 기대와는 다르게 래트에 컴팩틴을 처리해도 혈중 콜레스테롤 농도는 전혀 변화가 없었다. 가장 간단한 실험동물인 래트에 처리를 해도 효과가 없는 물질을 다른 실험동물에 처리할 것을 기대할 수는 없는지라, 이 단계에서 동물 실험은 중단되었다. 그러나 산쿄사에서는 이러한 부정적인 결과에도 불구하고 컴팩틴에 대한 연구를 계속하였다. 왜 세포에서는 강력한 콜레스테롤 저하를 나타내는 물질이 래트에서는 아무런 효과가 없는가? 이를 규명하기 위한 연구가 계속되었다.
이들은 래트에 컴팩틴을 처리한 후 3-8시간 내에 혈중 콜레스테롤을 측정하니, 콜레스테롤 수준이 바로 내려간다는 것을 관찰하였다. 그러나 8시간이 지나자 래트의 간에서 HMG-CoA 환원효소 양이 증가하기 시작하였다. 컴팩틴을 계속 투여하자 HMG-CoA합성효소의 양이 기존보다 8-10배 이상 증가하여 컴팩틴에 의한 효소의 저하 효과가 없어지게 된다는 것이었다[6]. 나중에 밝혀진 일이지만 컴팩틴과 같은 스타틴 계열의 약물은 콜레스테롤 합성이 저하되면서 LDL 리셉터를 많이 만들게 되고(세포 내 콜레스테롤의 농도가 낮아지므로 외부에서 콜레스테롤을 더 많이 흡수해야 하므로), 이에 따라 혈중 LDL 콜레스테롤의 농도를 낮추게 되는데, 래트의 경우 나중에 혈중 콜레스테롤이 LDL이 아닌 HDL로 주로 구성되어 있고 LDL 리셉터 자체의 발현이 매우 적다는 것이 알려지게 되었다. 즉 래트는 콜레스테롤 관련 연구를 하기에 애초에 적합한 모델이 아니었던 셈이다.
산쿄의 연구자들은 혈중 콜레스테롤 농도가 래트보다 높은 실험동물에서는 컴팩틴의 콜레스테롤 저하 효과를 관찰할 수 있을 것이라고 생각했다. 그런 동물이 어떤 동물이 있을까? 콜레스테롤 함량이 높은 달걀을 낳는 암탉이라면 어떨까? 때마침 산쿄의 병리학자인 키타노 노리토시라는 연구자는 다른 목적으로 암탉을 연구실에 가지고 있었고, 엔도의 연구팀은 기타노의 허락을 얻어, 컴팩틴이 암탉에서 콜레스테롤 저하 효과가 있는지를 시험했다. 컴팩틴의 투여 한달이 지나자 암탉의 혈장의 콜레스테롤 농도는 50% 감소하였다. 이러한 결과에 고무받아 다른 동물에서의 동물실험이 진행되었고, 개와 원숭이 등의 대동물 포유류에서도 컴팩틴이 콜레스테롤 저하 효과가 있다는 것이 관찰되었다[7]
주목할 만한 것은 이미 산쿄사와 동일한 물질을 먼저 발견했던 비첨사에서도 컴팩틴의 콜레스테롤 저하 효과를 시험했다는 것이다. 비첨사의 연구진들도 엔도 연구팀과 마찬가지로 컴팩틴은 래트에서는 혈중 콜레스테롤 농도를 낮추지 못한다는 것을 발견하였다. 그러나 다른 동물에서도 결과를 확인한 산쿄사와는 달리 비첨사에서는 래트에서 컴팩틴이 콜레스테롤 저하 효과를 내지 못한다는 결과를 얻고 더이상의 개발을 진행하지 않았다.
유전성 콜레스테롤 환자를 대상으로 한 최초의 임상 시험과 개발 중단
1978년 산쿄사는 오사카대학 병원과 협력하여 최초의 인간 대상으로 컴팩틴을 투여하는 연구를 시행하였다[8]. 최초의 실험 대상은 동형접합의 유전성 콜레스테롤 과다증 환자인 18세의 여성이었다. 총 11명의 환자를 대상으로 일일 50-150mg의 컴팩틴을 복용한 결과 평균적으로 혈중 콜레스테롤 농도가 27% 정도 감소되었다. 이러한 결과에 고무되어 산쿄사에서는 컴팩틴의 임상 개발에 착수하여 1978년 유전성 콜레스테롤 과다증 환자를 대상으로 임상 1상을 진행하였고 1979년 12개의 병원과 함께 임상 2상을 진행하게 되었다. 컴팩틴의 콜레스테롤 감소 효과는 명확했으며, 뚜렷한 부작용도 관찰되지 않았다.
그러나 1980년 산쿄사는 컴팩틴의 임상 개발을 중단하였으며, 그 이후 컴팩틴의 개발은 다시는 재개되지 못했다. 그 이유는 컴팩틴을 고용량(체중당 매일 100mg 및 200mg )으로 2년간 투여받은 개에서 종양이 발생하여 종양이 발생할 수 있는 위험성이 있다는 이유 때문이었는데, 이러한 용량은 환자에게 실제로 투여하여 콜레스테롤 감소 효과를 낸 용량보다 약 100배 이상 높은 용량이었다. 이러한 상황에서 산쿄사에서 컴팩틴의 개발 주역이었던 엔도 아키라는 1978년말 산쿄사를 퇴사하고 도쿄 농공대학으로 이직하게 되었다.
최초의 상업화된 스타틴인 로바스타틴(lovastatin)
산쿄사의 컴팩틴에 의한 콜레스테롤 저하 효과가 발표된 이후, 다른 제약회사에서도 컴팩틴과 유사한 활성을 미생물에서 탐색코자 하였다. 머크(Merck)도 그 중의 하나였으며, 머크는 1979년 곰팡이 Aspergillus terrus에서 메비놀린(mevinolin)이라고 알려진 콜레스테롤 저해 활성을 가진 물질을 분리하였다. 이 물질은 컴팩틴과 매우 유사한 구조를 가진 물질이었고, 이 물질은 나중에 로바스타틴(lovastatin)으로 명명되었다.
![▲그림 2. (좌) 컴팩틴(Compactin)과 로바스타틴 (Lovastatin)의 구조의 차이. 컴팩틴과 로바스타틴의 차이는 극히 미세하다. (우) 스타틴에 의한 혈장 내 LDL 콜레스테롤의 감소 기전. HMG-CoA 환원효소의 억제제인 스타틴에 의해서 세포 내 콜레스테롤의 생성이 저해되면, 세포는 이를 감지하여 SREBP 신호전달경로에 의해서 HMG-CoA 환원효소와 LDL 수용체의 발현을 증가시킨다. 세포 표면에 증가한 LDL 수용체에 따라서 더 많은 혈액 중의 LDL 콜레스테롤이 세포로 흡수되며, 혈액 중의 LDL 콜레스테롤 농도는 낮아지게 된다[9]](http://img.etoday.co.kr/pto_db/2018/11/700/20181106021947_1267719_1379_346.png)
▲그림 2. (좌) 컴팩틴(Compactin)과 로바스타틴 (Lovastatin)의 구조의 차이. 컴팩틴과 로바스타틴의 차이는 극히 미세하다. (우) 스타틴에 의한 혈장 내 LDL 콜레스테롤의 감소 기전. HMG-CoA 환원효소의 억제제인 스타틴에 의해서 세포 내 콜레스테롤의 생성이 저해되면, 세포는 이를 감지하여 SREBP 신호전달경로에 의해서 HMG-CoA 환원효소와 LDL 수용체의 발현을 증가시킨다. 세포 표면에 증가한 LDL 수용체에 따라서 더 많은 혈액 중의 LDL 콜레스테롤이 세포로 흡수되며, 혈액 중의 LDL 콜레스테롤 농도는 낮아지게 된다[9]
1980년 머크는 로바스타틴을 이용한 예비 임상시험을 시작하였으나, 산쿄에서 동물실험 도중 암 발생 때문에 프로젝트가 중단되었다는 소문을 듣고, 거의 비슷한 화학구조를 가진 로바스타틴의 개발 역시 중단되었다.
1981년, 브라운과 골드슈타인은 머크로부터 로바스타틴 약물을 제공받아서 개에 투여해본 결과, 개의 간에서 LDL 수용체의 양이 급격히 증가하였고, 혈액에서의 LDL 콜레스테롤은 감소함을 관찰하였다[10]. HMG-CoA 환원효소가 억제됨에 따라서 세포 내에서의 콜레스테롤의 생합성이 억제되고, 세포는 혈액 내에서 콜레스테롤을 더 많이 흡수하기 위하여 LDL 수용체를 더 많이 만들어내고, 이렇게 증가된 LDL 수용체 때문에 혈중 LDL 콜레스테롤의 수준은 감소하게 되는 것이다.
1981년 일본 카나자와 대학의 마부치 히로시(Mabuchi Hiroshi)의 연구팀은 7명의 이형접합 유전성 과다콜레스트레롤증 환자에게 컴팩틴을 24주간 투여하고(체중당 매일 30mg) 혈중 콜레스테롤 및 LDL 및 HDL을 조사하였다[11]. 이 결과 혈중 콜레스테롤 농도와 LDL 콜레스테롤 농도는 유의미하게 감소하였으나 HDL 콜레스테롤에는 변화가 없는 것을 확인하였다. 그러나 총 콜레스테롤과 LDL 콜레스테롤 농도는 컴팩틴의 복용을 중단하자마자 바로 원상회복되었다. 이 결과는 동물실험에서 관찰된 것처럼 실제로 인간 환자에서 스타틴의 투여에 의해서 혈중 LDL 콜레스테롤의 농도를 낮출 수 있다는 것을 보여준 것이다.
이러한 마부치의 결과는 다른 연구팀에 의해서 재현되고, 여기에 고무된 머크의 개발진은 로바스타틴의 개발을 재개하였다. 머크는 1986년 FDA에 로바스타틴의 승인을 신청하였고, 1987년 로바스타틴은 최초로 상업화된 스타틴으로 판매 허가를 얻었다. 산쿄사는 스타틴에 대한 연구를 선도적으로 진행하였음에도 불구하고 결국 스타틴이라는 새로운 종류의 신약을 시장에 처음 도입할 기회를 잃고 만 셈이다.
골드슈타인과 브라운은 1985년 LDL 리셉터와 콜레스테롤 조절 기전을 규명한 공로로 노벨 생리의학상을 수상하였으며, 엔도 아키라는 2008년 래스커상(Lasker-Debakey Clinical Medicine Research Award)를 수상하였다.
다음 연재에서는 스타틴이 유전성 고콜레스테롤증 이외에도 심혈관 질환의 발생율을 줄이는 질환으로써 블록버스터 의약품으로 대두되는 과정을 알아보도록 하자.
참고문헌
1. Endo, A. (2010). A historical perspective on the discovery of statins. Proceedings of the Japan Academy, Series B, 86(5), 484-493.
2. Endo A., Kuroda M. (1976) Citrinin, an inhibitor of cholesterol synthesis. J. Antibiot. (Japan) 29, 841–843
3. Endo A., Kuroda M., Tsujita Y. (1976) ML-236A, ML-236B, and ML-236C, new inhibitors of cholesterogenesis produced by Penicillium citrinum. J. Antibiot. (Japan) 29, 1346–1348
4. Brown A.G., Smale T.C., King T.J., Hasenkamp R., Thompson R.H. (1976) Crystal and molecular structure of compactin, a new antifungal metabolite from Penicillium brevicompactum. J. Chem. Soc., Perkin Trans. 1 1165–1170
5. Brown M.S., Faust J.R., Goldstein J.L., Kaneko I., Endo A. (1978) Induction of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in human fibroblasts incubated with compactin (ML-236B), a competitive inhibitor of the reductase. J. Biol. Chem. 253, 1121–1128
6. Endo A., Tsujita Y., Kuroda M., Tanzawa K. (1979) Effects of ML-236B on cholesterol metabolism in mice and rats: lack of hypocholesterolemic activity in normal animals. Biochim. Biophys. Acta 575, 266–276
7. Tsujita Y., Kuroda M., Tanzawa K., Kitano N., Endo A. (1979) Hypolipidemic effects in dogs of ML-236B, a competitive inhibitor of 3-hydroxy-3-methylglutaryl-coenzyme A reductase. Atherosclerosis 32, 307–313;Kuroda M., Tsujita Y., Tanzawa K., Endo A. (1979) Hypolipidemic effects in monkeys of ML-236B, a competitive inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase. Lipids 14, 585–589
8. Yamamoto, A., Sudo, H., & Endo, A. (1980). Therapeutic effects of ML-236B in primary hypercholesterolemia. Atherosclerosis, 35(3), 259–266. doi:10.1016/0021-9150(80)90124-0
9. Goldstein, J. L., & Brown, M. S. (2015). A century of cholesterol and coronaries: from plaques to genes to statins. Cell, 161(1), 161-172.
10. Kovanen PT, Bilheimer DW, Goldstein JL, Jaramillo JJ, Brown MS. Regulatory role for hepatic low density lipoprotein receptors in vivo in the dog. Proc Natl Acad Sci USA 1981;78:1194–8.
11. Mabuchi H, Haba T, Tatami R, et al. Effects of an inhibitor of 3- hydroxy-3-methylglutaryl coenzyme A reductase on serum lipopro- teins and ubiquinone-10 levels in patients with familial hypercholes- terolemia. N Engl J Med 1981;305:478–82.







