기사본문
[BioS 레터]마이크로바이옴 개발현황 및 개량균주 연구
입력 2020-08-07 10:06 수정 2020-08-07 10:06
박지은
활발한 연구, 투자, 사업화 3박자를 갖춘 마이크로바이옴
인간 마이크로바이옴(human microbiome)이란 인간의 몸에 공생하는 미생물 군집과 이러한 미생물 군집의 유전체를 의미하는 용어로, 마이크로바이옴이 인간의 건강과 긴밀한 상관관계가 있음이 밝혀지며 많은 관심을 끌고 있다. Web of Science 데이터베이스 기준, 2000년도 이후로 마이크로바이옴과 관련되어 게재된 논문은 5만 편 이상이다. 2005년 이전에는 연간 500편을 채 넘지 못하였으나, 2019년 12월 기준 연간 9,500편 이상의 논문이 게재된 것이다. 2000년대 이후로 연간 논문 게재 편수를 헤아려 보면 장내 미생물에 관한 연구가 급격한 증가 추세에 있음을 확인할 수 있겠다(그림 1).
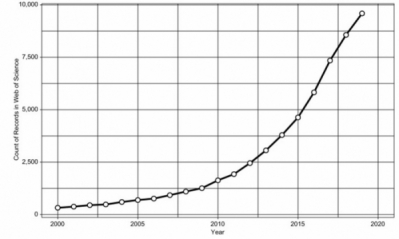
▲그림 1. Web of Science를 통해 검색한 연간 장내 마이크로바이옴 저널 발표 추이(출처: Protein Cell. 2020 Jun; 11(6): 391–400.)
미생물의 생태 시스템을 연구하는데 처음 사용된 방법은 배양 방법이다. 장내 미생물의 조성을 처음 연구한 논문 또한 혐기 배양(axenic culture)과 그람 염색을 통한 현미경 관찰이었다. 장 내부는 혐기 상태이므로, 혐기 환경에서 분변의 균종을 배양하고 그람 염색을 통해 장내 미생물의 조성을 확인한 것이다. 1960~1970년대의 논문 결과에 의하면, 사람의 분변에서 그람 양성균은 2~45%를 차지하는 것으로 보고되었다. 하지만 후일 배양의 특성으로 인해, 실제 미생물 조성보다 배양이 잘 되는 혐기균 위주로 확인된 것으로 밝혀졌고, 이러한 현상과 관련하여 Staley와 konopka는 1985년도에 “great plate count anomaly”라고 표현하며 실제 존재하는 미생물 중 극히 일부만 실험실 배양이 가능함을 공식적으로 보고하였다. 이로 인해 분자학적 방법으로 미생물을 연구하고자 하는 다양한 시도가 이루어졌으며, 2000년 이후로 메타지노믹스(metagenomics) 기법의 발달로 인간 장내 미생물에 관한 연구가 급격히 진전되었다. 후일 메타지노믹스 연구를 통해 밝혀졌지만, 분자학적 방법을 통해 확인된 장내 미생물 중 약 80%는 배양되지 않는 균종이었다.
이렇듯 무균동물모델(germ-free animal model), 차세대 염기서열 분석(Next-Generation Sequencing, NGS), 다중 오믹스 분석(multi-omics analysis) 등 연구 기법의 비약적 발전으로 인해 장내 미생물의 조성과 구조를 분석하는 것뿐만 아니라 마이크로바이옴의 기능과 질병과의 연관성을 연구할 수 있게 되었고 이에 따라 더 많은 연구 결과가 발표되고 있다. 특히 배양 독립적(culture-independent)인 유전자 수준에서 미생물 군집 분석 가능한 메타지노믹스 (metagenomics) 기술의 비약적 발전으로 인해 마이크로바이옴 연구가 폭발적으로 진척된 것이다.
활발한 연구와 더불어, 마이크로바이옴과 연관된 연구에 대한 투자 또한 국가 차원에서 활발히 이루어지고 있다. 대표적으로 Human Microbiome Project(HMP)가 있는데, 미국 국립보건원(NIH)은 HMP에 2007년부터 2016년까지 약 2,600억원을 투자한 바 있다. Nature에 기고된 바에 따르면, 10여년 동안 마이크로바이옴과 연관된 연구에 투자된 재원은 2조원을 넘어섰다. 활발한 연구, 국가 차원의 투자에 발맞춰 관련 산업에 대한 투자 역시 가파르게 성장 중이다. 2017년 기준 마이크로바이옴과 연관된 벤처 투자금액 중 가장 높은 지분을 차지한 분야는 치료제(Therapeutics)이며, 연구의 주요 분야로는 자가면역질환, 화장품, 두뇌와 장의 관계(Gut-brain axis), 감염병, 항암면역치료제(Immuno-oncology), 대사 증후군(metabolic disease) 등이다.
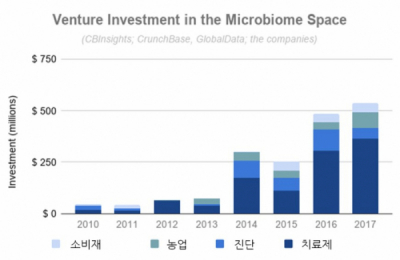
▲그림 2 마이크로바이옴과 연관된 벤처기업의 투자 규모(출처: https://www.global-engage.com/life-science/investing-microbiome-future/)
시장을 살펴보면, 현재 마이크로바이옴 시장은 프로바이오틱스(probiotics)와 프리바이오틱스(prebiotics) 중심으로 이루어져 있지만 질병과 마이크로바이옴의 연관성이 밝혀지고 있는 만큼 시장에서 치료제 부문이 급격히 성장할 것으로 예측되고 있다. 2017년 BCC Research에서 조사한 자료에 따르면, 인간 마이크로바이옴 치료제 시장은 2018년 5630만 달러에서 2024년 93억8700만 달러로 성장할 것으로 전망하며, 2019년부터 2024년까지 연평균 성장률(CAGR) 131%로 예측되었다.
마이크로바이옴 기반 치료제 현황
마이크로바이옴 기반 치료제를 개발 중인 해외 및 국내의 대표적인 업체와 파이프라인을 정리하면 하기(표 1)와 같다. 하기 업체 및 파이프라인은 Medgadget사에서 제공하는 리포트에서 2019년 마이크로바이옴 시장의 주요 업체(Key player)로 언급한 해외 업체 일부와 국내 업체 위주로 정리되어 있으며, 임상 2상, 3상 후보물질 위주로 기재되어 있다.

▲표 1. 2019년 마이크로바이옴 시장의 주요 업체(해외, 국내) 및 파이프라인(출처 : 각 사 홈페이지)
표 1에 정리된 내용을 살펴보면, 주요 업체의 파이프라인은 주로 위장관, 감염, 면역과 연관된 적응증을 기반으로 함을 알 수 있다. 위장관 장애 혹은 감염질환, 피부질환을 적응증으로 하는 후보물질이 선두주자(임상 2상 및 3상 진행 중)로 보이며, 암 치료 후보물질의 경우 아직은 초기단계 (전임상 혹은 임상1상 단계)인 것을 확인할 수 있다. 후보물질의 조성을 확인하면, single strain bacteria부터 다양한 균주의 조성으로 이루어지거나, 균주로부터 획득한 단백질/펩타이드로 구성되거나, 항암효과가 있는 단백질을 생산하는 유전자재조합 유산균까지 다양하게 구성되어 있다. 적용 방법 또한 피부 도포, 복용, 관장까지 다양하다. 분변이식과 신체 내에서 특정 메커니즘을 통해 질병에 연관을 미칠 수 있는 균주에 관한 내용은 잘 알려져 있으므로, 본 글에서는 개량된 균주를 치료제로 활용하고자 하는 최신 연구 동향에 대해 소개하고자 한다.
연구•개발자가 하는 상상은 다가올 삶의 멋진 부분의 예고편이다
상기 제목은 상상과 관련되어 알버트 아인슈타인이 남긴 명언(당신이 하는 상상은 다가올 삶의 멋진 부분의 예고편이다)을 본 글에 맞게 소폭 수정한 문구다. 장내 미생물과 신체의 상관관계에 대한 혁신적인 연구결과에 힘입어 미생물의 특성을 이용한 다양한 제품이 출시되고 치료제가 개발되는 것은 자연스러운 흐름이다. 이에 더불어, 미생물을 더욱 적극적으로 활용하는 방안으로 장내 생착한 균주가 치료 물질을 생산한다면, 체내 특정 신호에 따라 균주가 생산하는 단백질을 조정 가능하다면 어떨까? 연구개발자가 하는 상상과 시도는 그야말로 인류의 삶에 다가올 멋진 사회의 예고편이라 칭해도 무방하겠다. 균주를 개량하여 치료효과를 확인한 최신 연구 결과는 하기와 같이 크게 4가지로 정리할 수 있다.
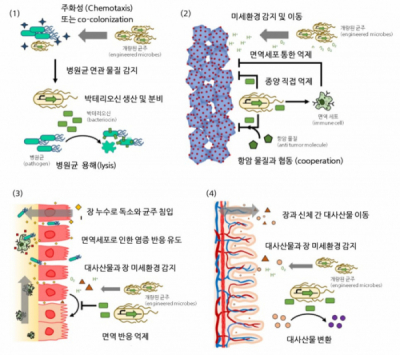
▲그림 3 개량된 균주 조절(control)을 통한 진단 및 치료 방법에 대한 모식도(출처: Curr Opin Biotechnol. 2020 Jun 18;66:11-17)
(1) 목표 병원균과 연관된 물질을 감지(sensing)하여 병원균 용해
병원균 연관 물질을 감지하고 그에 따라 병원균을 용해하는 단백질을 생산하도록 균주를 개량하여 치료효과를 확인한 연구결과가 보고된 바 있다. 2017년에 발표된 논문은 예쁜꼬마선충(C. elegans)과 동물(mouse)모델에서 효과를 확인하였는데, 개량된 균주가 특정 균주(Pseudomonas aeruginosa)를 감지한 후 균주를 용해(lysis)하는 단백질을 생산하여 감염원 제거를 통한 감염 치료효과를 확인한 바 있다. 또한 2020년에는 항생제 내성을 가진 Vibrio cholerae균을 감지하는 개량 균주를 활용하여 내성을 가진 특정 균을 사멸시킨 결과가 보고된 바 있다. 본 연구결과와 관련하여 치료 효율성을 향상시키기 위해 특정 균을 감지하여 부착하는 효율성을 높일 필요가 있다는 의견이 있으나, 체내에 공생하는 미생물 중 질병을 유발하는 균을 선택적으로 사멸시킬 수 있는 가능성을 확인한 흥미로운 연구 결과임엔 틀림 없다.
(2) 종양 미세환경을 감지하여 항암 물질 생산
종양의 특성상 종양 주변의 미세환경(microenvironment)은 낮은 산소와 낮은 pH가 형성된다. 이러한 종양의 미세환경을 감지하는 균주를 종양 주변에서 군집(colony)을 형성하게 하여 ①면역세포를 통해 ②균주가 생산하는 단백질을 통해 또는 ③함께 투약하는 항암 치료제와 협동하여 종양 세포 억제를 유도하는 연구결과가 보고된 바 있다. 2020년도에 미국 컬럼비아 대학 연구진은 종양에 check point blockade nanobodies를 효율적으로 전달할 수 있는 미생물 플랫폼(probiotic platform) 개발 가능성을 보고한 바 있다. 연구진은 동물모델(mouse)에서 종양세포의 PD-L1과 면역세포의 PD-1의 결합을 차단하는 나노바디를 생산하는 개량된 균주(Engineered bacteria)를 통해 PD-L1 단일클론항체를 투여하는 것과 유사한 효능을 확인한 바 있으며, 이를 통해 독성을 최소화하여 면역항암제를 암세포에 직접 전달하는 매개체로써 개량 균주의 가능성을 확인하였다.
(3) 장내 미세환경을 감지하거나 염증 특이적인 대사산물을 감지하는 균주를 통해 진단 또는 치료에 활용
장관 상피세포의 결합이 약해진 틈으로 균주나 다른 물질이 체내로 유입되면, 면역반응으로 인해 염증 반응이 일어난다. 이러한 장 내의 미세환경(microenvironment)을 인지하는 균주를 통해 염증 반응 진단에 활용 가능하며, 염증 반응을 저해하는 cytokine을 생산하도록 개량하여 염증 반응을 감소시키거나 장관 상피세포의 결합을 증가시키는 단백질을 생산하여 치료에 활용할 수 있다. 2019년 하버드 대학 연구진은 E. coli Nissle 1917(EcN) 균주를 개량하여 과민성 장 증후군(IBD)에서 매트릭스를 생성하여 장 점막을 보호하고 상피세포의 결합을 촉진하는 연구결과를 발표한 바 있다. 연구진은 이러한 균주를 PATCH(Probiotic-associated therapeutic curli hybrids)로 명명하였으며, PATCH가 장 내에서 매트릭스 자가 조립을 통해 장내 점막 장벽을 강화하여 dss로 유도한 장염 동물 모델에서 치료 효과를 확인한 바 있다.
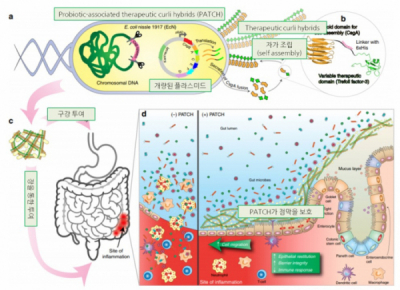
▲그림 5. 개량된 균주(PATCH)를 통해 장내 점막 장벽을 강화하여 장 염증 치료 가능성을 확인한 연구 결과의 모식도(출처: Nat Commun. 2019 Dec 6;10(1):5580.)
(4) 대사산물과 장내 미세환경을 감지하여 특정 대사산물의 불균형에 반응하여 건강을 유지하는데 활용
대사 산물은 상피세포 장벽(epithelial barrier)을 통해 혈관과 장관(gut lumen) 사이로 수송된다. 장내의 개량된 균주는 이러한 대사산물의 불균형을 감지하고 특정 대사산물이 정상 범주로 유지될 수 있도록 돕는 효소를 생산할 수 있다. 고암모니아혈증은 뇌에 손상을 입히고 죽음에 이르게 할 수 있는데, 2019년 연구결과에서 장내 혐기 환경에 반응하여 암모니아를 L-arginine으로 변환하여 고암모니아혈증을 감소시키는데 도움을 주는 개량된 균주를 개발하여 보고한 바 있다. 본 개량된 균주의 경우 SYNB1020으로 신로직(Synlogic)이라는 업체에서 개발 중인 치료제 후보물질이며, 전임상에서 효능을 확인하고 임상 1상에서 독성이 없음을 확인하였지만 안타깝게도 임상 1b/2a상에서 환자의 증상이 개선되지 않아 임상을 중단한 바 있다.
신로직은 개량된 균주(E. coli Nissle)를 활용한 페닐케톤요증 치료 후보물질(SYNB1618)도 보유하고 있어, SYNB1020 임상 중단을 보고할 당시 SYNB1618 후보물질에 집중하겠다고 발표한 바 있다. SYNB1618의 적응증인 페닐케톤요증은 페닐알라닌 분해 효소의 결핍으로 페닐알라닌이 체내에 축적되어 경련 및 발달장애를 일으키는 유전 대사 질환이다. 2018년에 발표한 결과에 따르면, SYNB1618은 미세혐기상태를 감지하고 페닐알라닌을 개량 균주 세포 내부로 운반한 뒤, TCA 회로를 거쳐 대사 산물을 배출하여 페닐케톤요증을 치료하는 작용 기전을 가지고 있다. SYNB1618은 임상 1/2a상을 완료하여 2019년 9월에 발표한 바 있다. 임상 2상 진행 예정이나, 현재(2020년 7월 기준) Clinical trial.gov에 SYNB1618로 검색되는 임상은 1상이 유일하다.
상기 (1) ~(4)에서 언급한 연구와 관련된 몇 가지 연구는 표 2에 정리되어 있다.
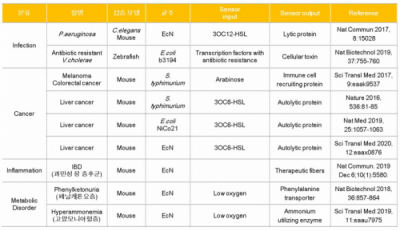
▲표 2. 개량된 균주 (Engineered microbe)를 통해 치료효과를 확인한 연구 결과(출처: Curr Opin Biotechnol. 2020 Jun 18;66:11-17.)
향후 전망
본 글의 도입부분에서 언급한 바와 같이, 16s RNA 혹은 메타지노믹 분석, 동물모델 등의 실험 기법의 발달로 인해 미생물 간(microbe-microbe interaction), 그리고 미생물과 신체(host-microbe interaction)의 상호작용에 대한 기전 연구가 진전되었다. 이러한 기전 연구를 통해 질병과의 연관성을 밝혀내었지만, 질병과 미생물의 연관성에서 인과관계가 명확하게 규명되지 않은 실정이다. 이는 즉, 미생물과 질병 간 연관성이 있음은 확인하였지만 어느 것이 원인이고 그에 따른 결과인지에 대한 설명이 아직은 부족하다는 것이다. 또한 유전자 발현의 정확한 조절과 이러한 조절이 장 내에 어떤 영향을 미치는지, 그리고 건강 상태에 어떤 영향을 미치는지에 대해서도 연구가 선행되어야 한다는 의견이 제기되고 있다.
개량된 균주의 향후 전망은 어떨까. 구강 투여를 통해 장내에 도달하기 어려운 치료제의 경우, 개량된 균주를 활용하는 방법이 임상의 미충족 수요를 만족시킬 수 있을 것으로 예상된다. 또한, 고용량 투여가 요구되는 과민성 장증후군(Inflammatory Bowel Disease, IBD), 암, 자가면역질환은 심각한 부작용을 낳기도 하는데, 개량 균주를 활용할 경우 장내의 목표에 도달하도록 조정하여 이러한 문제를 해결할 수 있을 것으로 기대되나, 이를 성취하기 위해서는 더 많은 연구가 필요하다는 의견 또한 제기되고 있다. 이상적으로는 개량을 통해 여러 종류의 약을 투약함으로써 시너지 효과를 얻을 수 있다는 의견도 존재한다.
개량 균주에 대한 내용을 포함하여 마이크로바이옴 연구에 대한 전망이 각양각색이지만, 마이크로바이옴 연구는 이제 태동일 뿐이며, 기술의 발전을 통해 마이크로바이옴과 연관된 질병에 대한 개인 맞춤 의학으로 나아갈 수 있기를 바란다.
[참고 자료]
1. Web of Science는 Clarivate Analytics가 제공하는 웹 데이터 베이스로, SCIE(Science Citation Index), SSCI(Social Sciences Citation Index), A&HCI(Art&Humanities Citation Index)를 동시에 검색 가능하다.
2. Lagier JC, Million M, Hugon P, Armougom F, Raoult D. Human gut microbiota: repertoire and variations. Front Cell Infect Microbiol. 2012;2:136.
3. Staley JT, Konopka A. Measurement of in situ activities of nonphotosynthetic microorganisms in aquatic and terrestrial habitats. Annu Rev Microbiol. 1985;39:321-346.
4. Eckburg PB, Bik EM, Bernstein CN, et al. Diversity of the human intestinal microbial flora. Science. 2005;308(5728):1635-1638.
5. Eckburg PB, Bik EM, Bernstein CN, et al. Diversity of the human intestinal microbial flora. Science. 2005;308(5728):1635-1638. doi:10.1126/science.1110591
6. Proctor L. Priorities for the next 10 years of human microbiome research. Nature. 2019;569(7758):623-625.
7. https://www.medgadget.com/2019/07/human-microbiome-market-2019-top-key-players-are-4d-pharma-plc-seres-therapeutics-second-genome-inc-microbiome-therapeutics-and-forecast-to-2025.html
8. Amrofell MB, Rottinghaus AG, Moon TS. Engineering microbial diagnostics and therapeutics with smart control [published online ahead of print, 2020 Jun 18]. Curr Opin Biotechnol. 2020;66:11-17.
9. Hwang IY, Koh E, Wong A, et al. Engineered probiotic Escherichia coli can eliminate and prevent Pseudomonas aeruginosa gut infection in animal models. Nat Commun. 2017;8:15028.
10. López-Igual R, Bernal-Bayard J, Rodríguez-Patón A, Ghigo JM, Mazel D. Engineered toxin-intein antimicrobials can selectively target and kill antibiotic-resistant bacteria in mixed populations. Nat Biotechnol. 2019;37(7):755-760.
11. Gurbatri CR, Lia I, Vincent R, et al. Engineered probiotics for local tumor delivery of checkpoint blockade nanobodies. Science Translational Medicine. 2020 Feb;12(530).
12. Praveschotinunt P, Duraj-Thatte AM, Gelfat I, Bahl F, Chou DB, Joshi NS. Engineered E. coli Nissle 1917 for the delivery of matrix-tethered therapeutic domains to the gut. Nat Commun. 2019;10(1):5580..
13. Kurtz CB, Millet YA, Puurunen MK, et al. An engineered E. coli Nissle improves hyperammonemia and survival in mice and shows dose-dependent exposure in healthy humans. Sci Transl Med. 2019;11(475):eaau7975
14. Isabella VM, Ha BN, Castillo MJ, et al. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nat Biotechnol. 2018;36(9):857-864.
15. Inda ME, Broset E, Lu TK, de la Fuente-Nunez C. Emerging Frontiers in Microbiome Engineering. Trends Immunol. 2019;40(10):952-973.







