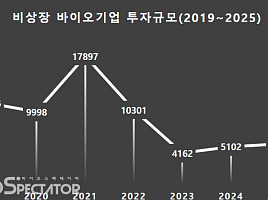
기사본문
FDA자문위, '미생물 치료제’ CDI 승인권고..세레스 “촉각”
입력 2022-09-28 08:26 수정 2022-09-28 08:42
바이오스펙테이터 김성민 기자
미국 식품의약국(FDA) 자문위원단이 장 감염질환인 클로스트리디움디피실 감염증(C. difficile infection, CDI)에서 페링 파마슈티컬(Ferring Pharmaceuticals)의 미생물 기반 약물(microbiota-based live biotherapeutic)에 대한 시판허가 권고를 내리면서, 그동안 잇따른 파트너십 종결과 임상실패, 구조조정 등 이슈로 침체돼 왔던 마이크로바이옴 분야의 분위기가 달라지고 있다.
이로써 첫 마이크로바이옴 치료제 시판이 가까워졌으며, 이는 페링을 뒤따라오고 있는 세레스 테라퓨틱스(Seres Therapeutics)에도 길을 터주는 분위기를 연출하고 있다. 세레스는 이번달 FDA에 SER-109의 허가신청서를 제출해, 내년 상반기 시판허가 승인과 출시를 바라보고 있다.
앞서 4년전 스위스 페링은 첫 마이크로바이옴 제품출시 가능성을 보고 임상3상 단계에 있는 리바이오틱스(Rebiotix)를 인수했으며, 올해 5월 ‘RBX2660(Rebyota)’의 2번째 임상3상에서 긍정적인 결과를 발표했다. RBX2660는 기존에 치료대안이 없는 CDI 환자에게 건강한 똥을 이식하는 분변미생물이식(fecal microbiota transplant, FMT)과 유사하며, CDI 재발을 줄이기 위한 치료법이다.
22일(현지시간) 열린 FDA 백신·생물의약품 자문위원회(VRBPAC)에서 페링의 RBX2660이 ‘재발성 CDI 감염증을 치료하는데 효과적인가’에 대해서 ‘13:4’로 찬성, ‘안전성을 뒷받침하는가’라는 질문에는 ‘12:4’로 그렇다는 의견이 나왔으며 1표는 기권이었다. FDA는 자문위원회 권고사항을 따를 의무는 없지만 일반적으로 의견을 반영해 결정을 내린다.... <계속>