기사본문
애브비, 블록버스터 '브레일라' 우울증도 "FDA 승인"
입력 2022-12-21 11:36 수정 2022-12-21 14:01
바이오스펙테이터 윤소영 기자

애브비(Abbvie)의 항정신병 약물 ‘브레일라(Vraylar, cariprazine)’가 우울증 치료제로 승인받으며 새로운 적응증을 추가한다. 미국내 가장 흔한 정신질환으로 적응증을 확장함에 따라 애브비는 브레일라가 연매출 40억달러의 블록버스터 약물이 될 수 있을 것으로 기대한다.
애브비는 지난 16일(현지시간) 브레일라가 주요우울장애(major depressive disorder, MDD) 보조요법(adjunctive therapy)으로 미국 식품의약국(FDA)의 승인을 받았다고 밝혔다.
이번 승인은 브레일라의 4번째 적응증으로, 브레일라는 양극성우울증(bipolar depression), 조증 혹은 혼재성 증상을 동반하는 양극성장애 1형(manic or mixed episodes associated with bipolar I disorder), 조현병(schizophrenia) 치료제로도 승인받았다.
애브비에 따르면 주요우울장애는 미국 성인의 1/5이 일생에서 한번은 경험하는 질환이다. 이중 반 이상의 환자들은 처방되는 항우울 치료제(antidepressant therapy, ADT)에 큰 효능을 느끼지 못해 새로운 요법의 우울증 치료제에 대한 수요가 있어왔다.
브레일라의 정확한 기전은 밝혀진 바 없다. 다만 애브비는 브레일라가 도파민D2(dopamine D₂), 세로토닌 5HT1A(serotonin 5-HT1A) 수용체에 대한 작용제로 작용하고 동시에 세로토닌 5-HT2A(serotonin 5-HT2A) 수용체에는 길항제로 작용해 다양한 정신질환에서 우울증상을 완화시킨다고 설명한다.
이번 승인은 751명의 환자를 대상으로 진행한 임상3상(NCT03738215), 808명의 환자를 대상으로 진행한 임상2상(NCT01469377) 결과를 바탕으로 한다. 임상3상에서 브레일라는 기존 항우울 치료제와 같이 사용됐을 때 치료 6주차 우울증 평가척도(MADRS)에서 통계적으로 유의미한 우울증 개선이 나타났다. 임상2상에서도 브레일라는 치료 8주차에 위약대비 유의미한 우울증 개선이 나타났다.
토마스 허드슨(Thomas Hudson) 애브비 CSO는 “많은 주요우울장애 환자들은 환자들이 받고있는 항우울 치료제가 일상생활에서 의미있는 효능을 준다고 생각하지 않는다”며 “이번 브레일라의 승인으로 이러한 환자들에게 중요한 새로운 옵션을 제공할 수 있게 됐다”고 말했다.
애브비는 지난 2월 열린 컨퍼런스콜에서 브레일라가 우울증 보조요법으로 승인받을 경우 연매출 40억달러를 달성할 수 있을 것이라고 밝힌 바 있다. 애브비의 2021년 실적보고서에 따르면 브레일라의 지난해 매출은 17억2800만달러였다.
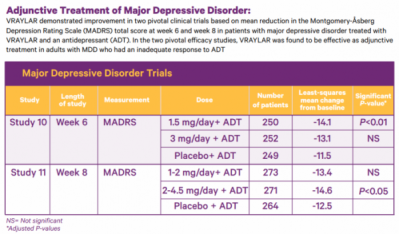
▲브레일라 주요우울장애 임상 결과(애브비 보도자료)







