기사본문
임상결과 공개범위 선진 제약사도 "천태만상"
입력 2016-07-25 15:43 수정 2017-12-19 17:07
문송이 객원기자
“환자들과 의료진이 임상시험의 결과와 신약의 허가근거를 이해할 수 있도록 하기 위해, 바이오제약기업들은 미국이나 유럽에서 허가받은 신약이나 새로운 적응증에 대해 적어도 임상시험보고서의 요약본(the Synopses of CSRs)을 공개해야 할 것이다.“
미국제약협회(PHRMA)가 공표한 정보공개의 원칙에는 위와 같이 허가받은 의약품의 임상결과를 일반인에게 공개하는 원칙을 2014년 1월부터 따르겠다는 선언이 포함돼 있다. 이를 바꾸어 말하면 2014년 이전에는 미국의 제약기업들에게 임상결과 공개가 책임이 아니었다는 말이다.
단지 10%미만의 약이 상업화에 성공하는 현실 하에서 모든 임상결과를 공개한다는 것은 제약사들에게 매우 부담스러운 일이었을 것이다. 2000년대 초반까지 선진 제약사들도 임상시험의 결과를 은폐해왔다는 것은 부인할 수 없는 사실이다. 실제로 임상시험의 실패는 이런 위험을 줄이기 위해 보다 성공가능성이 높은 우수한 약을 개발해서가 아니라 임상시험의 디자인을 안전하게 함으로써 줄어들었다는 평가도 있다.
그리고 보다 희귀하고 치료가 어려워 조금이라도 나은 약이 나오면 임상적으로 이익이 큰 질병에 대한 신약을 개발함으로써 약간의 임상적 이익만 확보되더라도 높은 가격을 받을 수 있는 쪽에 연구개발을 집중하게 된 것도 사실이다.
그리고 여전히 많은 약들이 불분명한 임상적 이익을 가지고 매우 고가에 판매되길 희망하고 있다. 사정이 이렇다보니 자발적인 공개라고 하지만 억지춘향 공개하는 임상결과가 선진 제약사들 사이에서도 천태만상이다.
바이오의약품 파이프라인에 있어서 세계 최고를 자랑하는 암젠(http://www.amgentrials.com)은 개발중인 약제의 경우 공개되는 정보의 범위가 Clinicaltrials.gov의 공개수준을 크게 넘지 않는다. 허가받아 판매중인 약제의 경우에도 모든 정보가 이미지형태의 PDF로 제공되기 때문에 내용 중 일부 원하는 부분을 검색해서 보는데도 어려움이 있다.
세계최대 헬스케어기업인 존슨앤존슨의 제약사업부인 얀센의 경우 결과자료 요청을 보내야 리포트를 받아볼 수 있다(http://www.clinicaltrialstudytransparency.com/home). 요청에 대해 검열하지 않는다고는 하지만 불편하게 함으로써 정보의 접근성을 떨어뜨렸다는 비난을 피하기는 어려워 보인다. 또한 환자, 연구자, 임상참여자가 볼 수 있는 자료의 범위를 한정하여 자료의 공개범위를 최소화하고 있다.
제약사 중 세계1위의 자리를 오랫동안 고수했던 화이자의 경우 임상종료 후 18개월 내 peer review 학술지 출간, 1년내 Clinicaltrials.gov 및 Edura-CT에 결과 업데이트(종료, 중단 등의 결과를 말하며 소아대상 임상의 경우 6개월내 업데이트)등 다른 회사들이나, 미국제약협회의 약속범위보다 성실히 정보공개의 책임을 다하기 위해 노력하고 있다. 심지어 화이자의 의약품에 대해 연구자가 임상디자인을 제안했으나 회사가 이를 거절한 경우도 거절 사유와 함께 공개하는 등 정보 투명성재고에 있어 한발 앞서가는 모습을 보여주고 있다. (http://www.pfizer.com/files/research/research_clinical_trials/Pfizer_EFPIA_PhRMA_commitments.pdf).
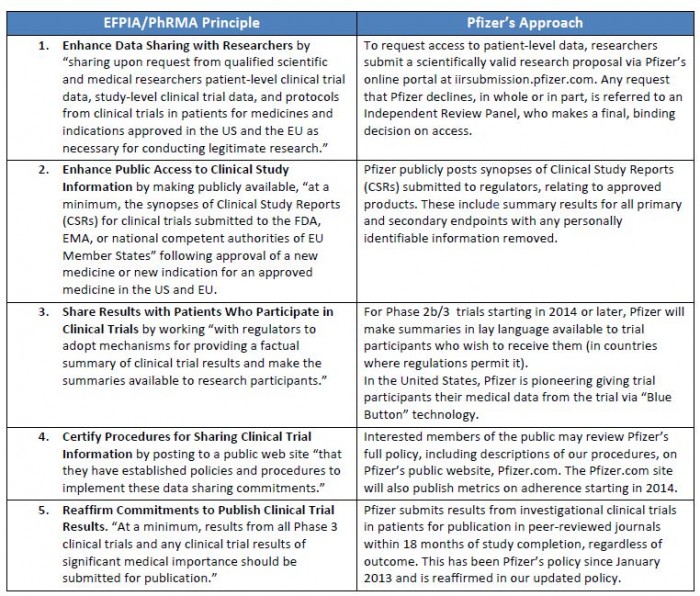
(▲화이자 홈페이지)
정보공개가 제약회사의 자발적인 노력에 의해 이루어진 것이 아닌 만큼 비판 받으면서 개선되고 또한 더 투명해질 것이라 기대할 수 밖에 없다.
이제 우리나라 바이오, 제약기업으로 돌아와보자. 한국기업들의 임상정보 공개수준에 대해 선진국의 잣대로 평가하는 것은 가혹하다 말할 수 있다. 아직은 선진 제약기업들보다 연구개발에서 노하우가 부족한 만큼 실패의 위험도 크고, 신약프로젝트가 많지 않은 만큼 실패 시 주주들의 실망도, 위험부담도 크다. 또한 이런 정보공개를 위해 전문인력을 고용해야 하는 부담도 따른다.
어떤 이는 이를 소위 ‘사다리 걷어차기’라고 말할지도 모른다. 선진국의 기준을 따르다 보면 부담만 가중되고 결국 그 위로 올라가지 못하게 되는 기준이라는 주장이다. 그러나 글로벌 신약을 개발하고, 상업화에 성공하려면 이 가혹한 기준을 처음부터 적용하는 것이 맞다고 본다.
셀트리온, 삼성을 비롯하여 한미, 중외 등 많은 제약사들이 세계적인 기업으로 성공하겠다고 연구개발 투자에 나서고 있고, 이에 부응해 많은 투자금과 주식가치 상승의 혜택을 경험하고 있다. 그만큼 책임감의 무게를 느끼는데 정보공개의 투명성만큼 중요한 부분은 없을 것이라 생각한다.
벼룩은 최대 자신의 몸길이의 350배까지 뛰어오를 수 있지만 20cm밖에 되지 않는 통에 가둬둔 벼룩은 나중에 그 통을 벗어나도 20cm남짓밖에 뛰어오르지 못한다고 한다. 어떤 기준으로 스스로를 단련시키느냐에 따라 발전의 가능성이 달라질 수 있다는 것이다.
다음편에서는 국내 제약사중 기술수출을 통해 글로벌 시장에 가까이 진입했다는 평가를 받고 있는 한미약품의 임상시험 결과 공개정도가 어느정도인지 살펴보도록 하겠다.







