기사본문
묵인희 서울대 교수가 말하는 알츠하이머 5가지 신접근법
입력 2017-09-14 07:12 수정 2017-09-14 07:12
바이오스펙테이터 장종원 기자
베타 아밀로이드 가설을 기반으로 한 알츠하이머병 치료제 개발 시도가 무수히 실패하면서 새로운 접근법이 대두되고 있다. 기존의치매 환자에게서 나타나는 베타 아밀로이드와 아밀로이드 플라크의 형성을 억제하려는 시도를 넘어 좀 더 거시적인 접근이 필요하다는 의견이 힘을 얻고 있다. 신경세포간의 커뮤니케이션, 신경세포와 상호작용을 하는 교세포의 역할, 베타 아밀로이드와 과인산화된 타우(tau) 단백질의 시너지 효과에 주목한 접근법들이 대표적이다.
국내 알츠하이머병 전문가인 묵인희 서울의대 교수(생화학과)는 14일 생명공학정책연구센터에 기고한 글에서 "모든 알츠하이머병 기전 연구의 최종적인 목적은 근본적인 치료제 개발에 있지만 기존의 베타 아밀로이드 가설에 집중돼 있는 치료제 개발 및 단일 신경 세포에만 국한된 기전 연구는 이미 그 한계를 드러내왔다"면서 알츠하이머병 치료제 개발을 위한 5가지 새로운 접근법(기전연구)에 대해 소개했다.
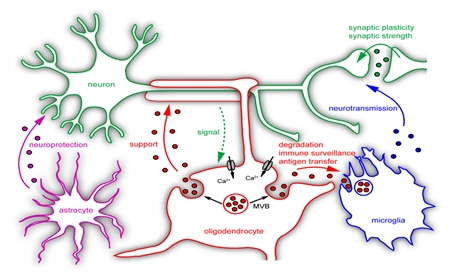
▲뇌 내 신경세포와 다양한 교세포들 간의 communications. Fruhbeis et al., 2012
첫번째는 뇌에 있는 신경세포와 다양한 교세포의 상호관계에 대한 연구다. 교세포에는 희돌기교세포(oligodendrocytes)와 성상세포(astrocytes), 그리고 미세교세포 (microglia)가 있는데 뇌에 1조개의 세포가 존재한다면 약 1000억 개가 신경세포에 해당되며 나머지 9000억 개는 교세포다.
희돌기교세포는 미엘린 수초를 형성하는 것이 주된 기능이지만 영양공급 및 구조의 지지에도 부분적인 역할을 수행하며 성상세포는 신경세포가 시냅스를 생성하는 과정에도 관여하며 신경세포 사이사이에 가지를 뻗어 신경세포에 영양을 공급하고 또한 해로운 물질이나 뉴런으로부터의 노폐물을 제거하기도 한다.
미세교세포는 신경세포로부터 분비되어지는 많은 신호들을 받아서 활성화가 되며 제거가 필요한 비정상 단백질이나 죽은 신경세포 등을 제거하는 역할을 한다. 묵 교수는 "뇌에는 신경세포뿐만이 아니라 수많은 다양한 교세포들이 존재하므로 신경세포만을 연구하기 보다는 신경세포와 다양한 교세포들과의 상호관계 등에 대한 연구가 활발히 이루어지고 있다"고 설명했다.
두번째는 신경세포간의 커뮤니케이션에 대한 접근이다. 신경 세포는 하나의 세포가 단독으로 뇌의 기능을 수행하는 것이 아닌 인접한 다른 신경세포들과 시냅스라는 구조를 통해 신호를 주고받음으로써 다양한 정보를 받아들이고 저장하는 기능을 한다는 점을 주목한 것이다. 시냅스는 인접한 두 신경 세포가 연접해 만드는 구조로서 전기적인 신호로 전달된 신호는 신경전달물질을 이용해 화학적 신호로 바뀌어 시냅스를 통과하게 된다. 한 신경세포가 만들어내는 시냅스는 대략 1000여개 이상으로 시냅스 신호전달은 학습 및 기억의 중요한 기전으로 받아들여지고 있다는 설명이다.

▲tau의 세포내 이동에서의 BIN1작용 기전. Calafate et al., 2016
특히 tau가 신경세포간 이동 경로에 대한 연구, 분비된 tau가 다른 신경세포로 어떠한 경로를 통해 흡수(uptake)되는 지에 대한 기전에 대한 연구가 활발하다. 최근에는 Bin1이라는 단백질이 엉킨 타우가 막단백질 clathrin을 매개로 해 세포안으로 흡수(endocytosis)될 때 특이적으로 작용함이 밝혀 졌으며 또한 이후 세포내에서의 tau 단백질 이동에서 Bin1이 중요한 역할을 하는 것이 보고됐다.
세번째는 알츠하이머병의 분자기전 연구의 중심이 되는 베타 아밀로이드와 과인산화된 tau 단백질의 시너지 효과에 대한 것이다. 베타 아밀로이드와 과인산화된 tau 단백질 모두 신경독성을 일으키는 것으로 알려져 있으며 과인산화 된 tau는 인지기능 및 기억 능력 저하의 원인이 되는 직접적인 요소로 받아들여지고 있다. 이에 따라 알츠하이머병의 병인기전으로 베타 아밀로이드로 인해 촉발된 변화가 여러 세포나 신호전달 체계를 거쳐 tau 단백질의 비정상적인 변화를 유도하는 트리거(trigger)로 작용할 것이라는 학설이 대두됐고 많은 논문들이 이를 뒷받침 해 주고 있다. 묵 교수는 "한 예로 PlexinA4가 Semaphorin3에 의해 tau의 인산화를 조절하는 현상을 알츠하이머병을 모델로 보고됐는데 이는 베타 아밀로이드에 의해 작동할 것으로 추측된다"면서 "베타아밀로이드에서 tau에 이르는 세포 내 신호전달체계를 찾기 위한 많은 노력들이 있으며 tau의 인산화에 관여하는 GSK3β, cdk5, Fyn, CaMKII, Akt 등의 많은 kinase등이 베타아밀로이드에 의해 어떻게 활성화가 되는지에 관한 연구가 활발하다"고 설명했다.
네번째는 뇌 내 신경회로에 대한 고찰이다. 뇌의 신경세포들은 많은 다양한 시냅스를 조절함으로써 서로간의 네트워크를 형성하고 있으며 이들 중 알츠하이머병에 중요한 기억에 관련된 신경회로가 존재하는 것으로 알려져 있다. 베타 아밀로이드나 과인산화된 tau 단백질에 의한 단일 신경세포들의 세포사 및 기능 이상보다는 신경해부학적 회로에 기초한 알츠하이머병의 병인기전을 규명하고 탐구하는 것을 중시하는 접근법이다. 이를 위해 특이적인 신경회로를 규명하기 위해 특정 회로를 활성화(channel rhodopsin) 혹은 불활성화(halorhodopsin) 하는 방법이 도입됐다. 알츠하이머병에서 특이적으로 회로가 망가지는 기전에 대한 연구도 tau의 전파에 초점을 맞추고 있다. 알츠하이머병의 초기단계에서 가장 먼저 내후각피질(Entorhinal cortex; EC)이 영향을 받는 것으로 알려져 있으며 질병의 진행과 밀접한 관련이 있는 과인산화된 타우 단백질이 질병의 초기 단계에서 EC 부위에 가장 먼저 특이적으로 축적된다고 밝혀진 바 있다.
묵 교수는 "Mucke group에서는 알츠하이머병의 경우에는 흥분성 뉴런(excitatory neuron)과 억제성 뉴런(inhibitory neuron)의 균형이 깨지면서 기억과 학습의 기전이 제대로 일어나지 않는다는 것이라는 학설을 주장하고 있으며 전세계 연구그룹에서 특이적 신경회로들을 타깃으로 하나하나 규명해 나가고 있다"고 전했다.
마지막은 뇌에 상주하는 면역세포이자 중추 신경계 면역계에 중요한 역할을 '소신경교세포(Microglia)'를 주목한 접근법이다. 알츠하이머병에서 microglia는 식세포 작용에 의해 베타 아밀로이드의 제거에 기여하여 알츠하이머병의 진행을 지연시키는 것으로 연구돼 왔다. 하지만 베타아밀로이드에 의해서 microglia가 활성화되고 과다한 활성을 통해 뇌염증을 일으킨다는 보고도 있다.
기존에 일반적으로 알려진 microglia의 표현형은 항 염증성 표현형인 M2와 염증성 표현형인 M1이 있다. 최근에는 좀 더 세분화된 서로 다른 특성을 보이는 인자들의 탐구를 통해 microglia가 아밀로이드 플라크의 제거 및 과도한 염증반응 사이의 균형에서 어떻게 조절되어 알츠하이머병의 병인에 작용하는지 그 기전을 밝히는 노력이 진행되고 있다는 설명이다.
묵 교수는 "인간의 뇌는 수많은 신경세포가 개별적으로 작용하는 것이 아닌 수없이 많은 네트워크를 형성해 서로간 무수한 커뮤니케이션을 통해 기능을 수행한다. 또한 신경세포뿐만이 아니라 뇌에 가장 많은 비율을 차지하는 교세포들의 기능 및 역할에 대한 연구 또한 중요하게 다뤄져야 한다"고 설명했다.
그는 이어 "기존의 베타 아밀로이드 혹은 타우 단백질의 독립적인 각각의 분자적 영향을 다루기보다는 상호 연계점을 찾아 생리학적으로 생체와 유사한 시스템을 고려하며 연구가 이루어져야 할 것"이라면서 "이러한 관점으로 이루어지는 알츠하이머병에 관한 새로운 기전 연구는 보다 정확하고 근본적인 치료제 개발에 기여할 것으로 전망된다"고 덧붙였다.







