기사본문
신라젠 '펙사벡', PD-1 항체 병용투여 임상1b 승인
입력 2018-02-28 09:56 수정 2018-02-28 09:56
바이오스펙테이터 김성민 기자
신라젠이 항암바이러스 '펙사벡(Pexa-vec)'을 면역관문억제제와 병용투여하는 임상1b상에 돌입한다. 27일 식품의약품안전처에 따르면 신라젠은 전이성 또는 절제불가능한 신세포암(RCC, renal cell carcinoma) 환자를 대상으로 리제네론의 PD-1 항체인 'REGN2810'와 병용투여해 용량증량(dose-escalation)하는 임상1b상을 진행한다. 펙사벡은 정맥투여(intravenous) 혹은 종양부위에 직접투여(intratumoral)된다.
임상1b상은 다국가 임상으로 총 80명 환자를 대상으로 진행되며, 국내에서 50명의 환자가 참여할 계획이다. 삼성서울병원, 연세대학교의과대학 세브란스병원, 동아병원, 부산대학교병원, 분당서울대학교병원 등 11개의 임상기관에서 수행한다. 임상수탁기관(CRO)인 아이콘클리니컬리서치코리아가 임상을 대행하며, 임상은 2020년 중반에 종료될 예정이다.
국제 임상시험 등록사이트 Clinical Trials에 따르면 글로벌 임상은 올해 4월에 임상에 들어가 비슷한 시기인 2020년 9월에 종료된다(NCT03294083). 임상이 계획대로 진행될 경우 2021년에 병용투여 임상결과를 확인할 수 있을 것으로 예상된다.
이번 REN026 임상은 총 3개의 약물투여군으로 나눠 진행하며 2주 간격으로 펙사벡을 종양내 직접투여(3회) 및 REGN2810을 3주 간격으로 투여(4회)하는 치료군, REGN2810을 3주 간격 투여(4회)후 진행성질환(PD)이 나타날 경우에만 펙사벡을 직접투여하는 치료군, 매주 펙사벡 정맥투여(4회) 및 REGN2810을 3주 간격으로 투여(4회)하는 치료군으로 나눠 안전성, 전체 반응률 등을 확인하는 임상 1b상이 진행될 예정이다.
1차 충족점으로는 최대내약용량(MTD, Maximum tolerated dose), 최대허용용량(MFD, Maximum feasible dose)와 정맥투여에 따른 안전성 및 전체반응률(ORR)이 평가된다. 2차 충족점으로는 무진행생존기간(PFS), 질병통제률(DCS), 전체생존기간(OS) 등을 확인한다.
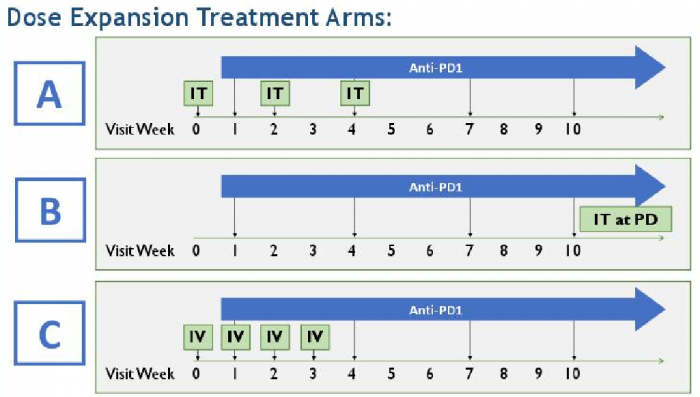
▲신장암 환자를 대상으로 PD-1 항체인 'REGN2810'를 병용투여할 계획인 ‘REN026’ 임상디자인
한편 펙사벡은 정상 백시니아 바이러스에서 유전자 복제에 핵심적인 요소인 TK 유전자를 비활성해 암세포 특이적으로 작용하도록 조작했으며, 동시에 수지상세포(DC, dendritic cell)를 활성화하는 GM-CSF라는 유전자를 삽입한 형태를 갖는다.







