기사본문
[김태형의 게놈이야기]AACR서 만난 3가지 액체생검 임상
입력 2018-05-02 10:10 수정 2018-05-02 10:36
김태형 테라젠이텍스 이사
지난 4월 미국 시카고 맥코믹 플레이스(McCormick Place) 컨벤션센터에서 열린 2018 미국암학회(AACR) 연례미팅에는 전세계 2만 3000여명의 암 연구자가 참여해 성황리에 진행됐다. 1907년 이후 110주년을 맞는 AACR 역사상 가장 많은 연구자가 모인 행사였다.
이번 학회의 주요 키워드는 단연코 면역항암제와 액체생검 임상시험이었다. 주요 기조 발표를 비롯해 각 세션의 연자들은 암 환자를 대상으로 치료 효율을 높이기 위한 면역항암제와 조기진단을 위한 액체생검의 다양한 임상 시험(clinical trial)결과를 내놓았다. 이중 혈중 종양 DNA(circulating tumor DNA, ctDNA) 분석기술에 기반을 둔 그레일(GRAIL)의 주요 임상시험 2건과 찰스 스완톤(Chares swanton)의 TRACERx 액체생검 임상시험 결과를 소개하고자 한다.
▲AACR18, GRAIL 알렉산드(Alexander M. Aravanis) 박사 발표.
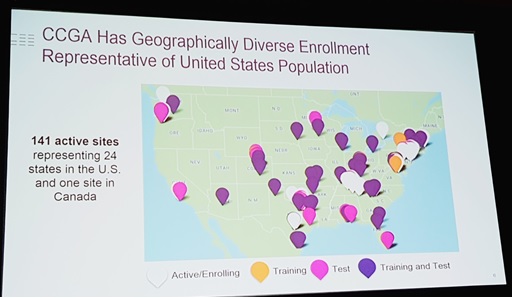
먼저 그레일(GRAIL)은 작년 1조원 이상의 투자를 받아 CCGA(>1만5000 명)와 STRIVE(>12만명) 두 건의 전향적 대규모 종단 임상시험을 진행하고 있는데, 이번 학회에서 처음으로 CCGA 임상시험 결과를 공식적으로 발표했다. 현재 미국의 24개 주 141곳, 캐나다 1곳의 의료기관과 협력해 임상시험을 진행중으로 2016년 8월 시작 당시 1만1648명의 암 환자/정상인이 참여했으며 현재까지 1만5000명 모두 임상시험에 참여했다. 암 환자가 약 70%, 나머지 30%는 암을 진단받지 않은 정상인으로 구성돼 있다.
이번 발표에서는 모두 2800명의 암환자/정상인을 대상으로 한 결과를 발표했는데 환자의 주요 암 종은 유방암, 폐암, 전립선암, 대장암이었다. 2500명의 참여자 중 트레이닝 셋으로는 1792명, 테스트 셋으로는 1008명을 참여시켜 그레일이 개발한 진단기술이 암 환자와 정상인을 잘 구분할 수 있는지 확인하기 위한 교차 검증을 진행하였다.
그레일은 모든 참여자를 대상으로 주기적으로 혈액에 존재하는 백혈구(WBC)와 혈장(Plasma)을 제공받아 전장유전체분석(Whole Genome Sequencing), 타깃유전자 및 전장 유전체 메틸레이션 분석(targeted & whole-genome bisulfite sequencing)뿐만 아니라 분석 혈장 내 존재하는 RNA를 대상으로 분석하는 전장 전사체 분석(whole transcriptome sequencing)도 함께 진행했다. 암 환자의 경우에는 암 수술 또는 조직 생검(tissue biopsy)를 통해 얻은 암 조직 샘플을 이용해 전장유전체분석(Whole Genome Sequencing)도 실시하였다.
또한 자체 개발한 차세대 유전체 해독(Next Generation Sequencing) 기술 기반의 507개 타깃 유전자 패널을 이용 6만X 이상을 해독하고 결과를 분석하여 이 기술의 민감도(sensitivity)와 특이도(specificity)를 측정하였다. 그 결과 최종 유전체 분석에 들어간 580명의 암에 걸린 적이 없는 정상인에서 5명 정도가 위양성(<1%)이 나왔으며 혈장 내 존재하는 혈중 종양 DNA 검출 능력은 3기, 4기 대장암 환자들의 경우 85% 민감도와 1기, 2기 대장암 환자의 경우 50% 이상의 민감도를 보였다.
더불어 그레일의 패널을 통해 생산된 수천명의 환자로부터 유래된 높은 배수의 딥 시퀀싱(deep sequencing) 데이터에서 발생하는 체세포 변이 콜 에러를 제어하기 위해 머신러닝(machine learining)을 적용했다.
이번 그레일의 CCGA 임상시험 결과 발표는 전례가 없는 대규모 전향적 종단 임상시험의 결과에 그치지 않고 그레일의 조기암 진단(early cancer detection) 기술을 개발하기 위한 중요한 토대가 될 뿐만 아니라 다른 회사나 연구소가 이러한 기술을 개발 시 중요한 이정표가 될 수 있을 것으로 보인다.

▲AACR18, 홍콩과기대 데니스 로 박사 (GRAIL) 발표.
두 번째 소개할 그레일의 임상시험 결과 발표는 홍콩중문대학의 데니스 로(Dennis Lo) 교수의 발표이다. 데니스로는 1997년 액체생검 기술 기반의 비침습적 태아 기형아 검사(NIPT)를 세계 최초로 발표한 과학자로서 이를 통해 현재 전 세계 수백만 명의 임산부가 이 서비스를 받고 있다.
데니스 로가 2014년에 설립한 시리나(Cirina)는 약 1년 전, 2017년 5월 말에 그레일에 합병됐는데 조기암 진단을 위해 혈액에서 암세포에서 유래된 바이러스 DNA를 정확하게 검출함으로써 암을 진단하는 핵심적인 기술을 기반으로 그레일의 대규모 연구자금을 투자 받아 홍콩(2만 명)과 중국 남부지역(2천만 명) 인구집단을 대상으로 대규모 임상을 진행 중에 있다. 이번 미팅에서는 그레일 소속으로 현재 진행 중인 임상연구의 결과 발표가 있었다.
작년에 NEJM에 발표한 비인두암을 타깃으로 3년간 고위험 정상인 그룹(40-60세 남성) 약 2만명을 대상으로 비인두암 진단 전, 비인두암의 원인이 되는 EBV(Epstein-Barr virus)를 검출하는 연구의 소개로 시작하여 현재 중국 남부 지역에서 사상 최대 규모인 2000만 명을 대상으로 한 임상연구 결과를 소개했다.
과거 홍콩의 인구집단 2만명을 대상으로 진행한 연구의 경우에는 민감도 97.1%, 특이도 99.3% 위양성(false positive) 빈도 0.7% 정도로 결과를 얻어 이 기술이 혈장 내 EBV 바이러스 DNA를 검출하는 데 매우 안정적임을 증명했으며 조기 비인두암 환자 발견을 통해 생존률을 극적으로 높였다고 발표했다. 이어서 EBV 바이러스 DNA의 양과 사이즈에 따라 분석하는 기법을 달리해 정확도를 더 높였으며 이 기술을 적용해 현재는 중국 남부 인구가 1억 명 이상 밀집된 광저우시와 센젠시를 중심으로 한 광둥성 지역에서 40-65세의 비인두암 고위험군 남성 약 2000만 명을 대상으로 비인두암 검출 서비스를 진행 중이며 이 연구 결과를 소개했으며 곧 공식적으로 연구결과를 발표할 것으로 보인다.
마지막으로 소개할 액체생검 임상시험 연구 결과 발표는 영국의 프랜시스 크릭 연구소(Francis Crick Institute) 책임자인 찰스 스완톤(Chares swanton)의 TRACERx(TRAcking Cancer Evolution through Therapy(Rx))이다.

▲AACR18, 프란시스 크릭 연구소 찰스 스완톤 박사 발표
찰스 스완톤은 2014년부터 약 10년간 250억원의 임상 연구비를 투입해 비소세포폐암(NSCLC)환자 842명을 대상으로 폐암 진단부터 재발 그리고 사망에 이르기까지 암의 이질성(heterogeneity)과 그 암의 진화적 궤적을 추적해 암의 진화 메커니즘을 밝혀내려는 목표로 대규모 임상연구를 진행했으며 작년 2017년 5월과 6월에 잇달아 Nature와 NEJM에 발표했다.
이번 발표에서는 액체생검 기술을 통해 암이 재발하기 전에 조기에 미세잔존암(minimal residual disease, MRD)을 폐암 환자 혈액에서 성공적으로 검출 가능하다는 발표였다.
보통 혈장 20cc에는 평균 30ng의 세포유리DNA(cell free DNA, cfDNA)가 추출되는데 여기에는 약 9000개의 반수체 유전체(haploid genome)가 존재한다. 보통 3기, 4기 암 환자의 경우 많게는 10% 적게는 0.1%까지 다양하게 암 환자의 혈중 종양 DNA(circulating tumor DNA)가 검출되는데 이 논리로 계산해보면 10%일 경우 약 900개의 돌연변이 카피(mutant copy)들이 존재하며 1%라 하더라도 9개 정도의 돌연변이 카피가 존재하게 된다. 또 종양의 직경 크기도 예측해 혈중 종양 DNA양이 0.01% 존재할 시 종양 크기는 최대 직경(Max diameter)이 1.4cm이며, 10%일 때는 10.4cm로 매우 큰 종양이 존재한다는 것을 밝혀냈다. 이러한 정밀한 액체생검 기술과 차세대 유전체 해독 기술을 결합시켜 폐암 환자들을 주기적으로 스크리닝 하면 기존의 임상 지침에 따라 암이 진단되는 경우보다 6개월에서 1년 먼저 앞서 미세잔존 암을 검출할 수 있었다고 한다.
또한 이런 연구 결과를 바탕으로 새로운 보조 항암치료를 적용하기 위한 임상시험을 시작했으며 그 임상시험 디자인을 소개하기도 하였다.
비소세포폐암 환자를 대상으로 암을 진단받고 수술 후 2일째 그리고 30일째 되는 날 20cc의 혈장을 얻어 이를 분석해 미세잔존암이 존재하는 경우 암 환자 절반은 기존 임상 가이드라인에 맞춰 진단하고 치료하는 방식으로 진행하고 나머지 절반은 액체생검만으로 진단받은 후 암 재발을 기존 진단 방법으로 발견하기 이전에 BMS 면역항암제인 니볼루맙(Nivolumab, 옵디보)을 처방해 기존 암환자 진단을 위한 임상 가이드라인을 넘어 액체생검 기반으로 조기에 암환자 개인별 맞춤 진단을 통해 암 환자 치료 효과(treatment outcome)가 개선이 되는지를 보고자 하는 임상시험을 진행중에 있다는 발표가 있었다.
이번 학회에 참석해 진행 중인 대규모 액체생검 기반의 성공적인 임상시험 중간 결과 발표를 보면서 느낀 점은 차세대 유전체 해독(NGS)기술 기반의 혈중 종양 DNA를 검출하는 방식이 아직 한계도 많고 해결할 문제가 많이 있지만 수백~수만개의 암 유전체 마커를 극소량의 혈액에서 더욱더 정확하게 검출해내는 차세대 유전체 해독기술 기반의 차별화된 액체생검 기술이 더욱 빠르게 발전하고 있다는 것이었다. 몇 년 안에 병원 현장에서 암을 조기에 진단하는 방식으로 임상에 적용되는 시점이 생각보다 빠르게 다가올 것으로 예상이 된다.







