기사본문
AZ '칼퀸스' 적응증 확대..CLL SLL 치료제로 FDA 승인
입력 2019-11-25 06:36 수정 2019-11-25 06:45
바이오스펙테이터 서일 기자

아스트라제네카(Astrazeneca)의 BTK 억제제(bruton’s tyrosine kinase)인 '칼퀸스(Calquecne, acalabrutinib)'가 적응증 확대에 성공했다. 기존에 외투세포 임파종(mantle cell lymphoma, MCL) 치료제인 칼퀸스는 지난 21일(현지시간) 미국 식품의약국(FDA)으로부터 만성 림프구성 백혈병(chronic lymphocytic leukaemia, CLL) 혹은 작은 림프구 림프종(small lymphocytic lymphoma, SLL)을 가진 성인 환자를 대상으로 한 치료제로 승인받았다.
칼퀸스는 지난 2017년 10월 이전 치료를 받은 적이 있는 성인 외투세포 임파종(mantle cell lymphoma, MCL) 치료제로 FDA 승인을 받았다. 파이퍼 제프리(Piper Jaffray) 애널리스트에 따르면 칼퀸스는 지난 2018년 MCL 치료제로 1억800만달러 매출을 올렸다. 최근 중국 베이진(BeiGene)은 BTK 저해제인 '브루킨사(Brukinsa™, zanubrutinib)'를 MCL 치료제로 FDA 승인을 받았다.
이번 칼퀸스의 FDA 판매승인은 전에 치료받지 않은 CLL환자 대상으로 한 ELEVATE-TN 임상 3상과 재발성(relapsed) 혹은 불응성(refractory) CLL 환자 대상으로 한 ASCEND 임상 3상 결과 분석을 바탕으로 이루어졌다. 아스트라제네카는 이들 임상에서 1차 종결점인 무진행생존기간(progression-free survival, PFS)을 유의미하게 개선시켰다.
EVEVATE-TN 임상 3상(NCT02475681)은 총 535명의 환자를 대상으로 칼퀸스 단독투여군, 칼퀸스+오비누투주맙(obinutuzumab) 병용 투여군, 표준치료법인 루케란(Leukeran, chlorambucil) 화학요법+오비누투주맙 병용투여군과 효과를 비교한 임상이다. 칼퀸스 단독 투여군에서 질병 진행(disease progression) 또는 사망(death) 위험도(risk)는 80% (HR 0.20; 95% CI, 0.13-0.30, p<0.0001), 칼퀸스+오비누투주맙 병용투여군은 90% (HR 0.10; 95 % CI, 0.06-0.17, p <0.0001) 감소했다. 칼퀸스+오비누투주맙 병용투여군과 칼퀸스 단독투여군에서 질병진행도 평균 시간은 루케란+오비누투주맙 병용투여군의 22.6개월(95 % CI, 20-28)에 도달하지 않았다.
아스트라제네카는 ELEVATE-TN 임상 3상 중간결과의 자세한 분석을 다가오는 12월 미국 혈액학회(American Society of Hematology)에서 발표할 예정이다.
ASCEND 임상 3상(NCT02970318)은 총 306명의 환자를 대상으로 재발성(relapsed) 혹은 불응성(refractory) CLL 환자 대상으로 칼퀸스 단독투여군과 표준치료제인 리툭시맙(Rituximab)+이델랄리십(idelalisib) 혹은 리툭시맙+벤다무스틴(bendamustine) 병용투여군의 효과를 비교한 임상이다. 칼퀸스 단독 투여군에서 질병 진행(disease progression) 또는 사망(death) 위험도(risk)는 69% (HR, 0.31; 95% CI, 0.20-0.49, p<0.0001) 감소했다. 칼퀸스 단독투여군에서 질병진행도 평균 시간은 16.5개월동안 대조군에 도달하지 않았다. 12개월까지 대조군 68%과 비교해 칼퀸스 단독 투여군의 88%가 질병 진행을 보이지 않았다. 아스트라제네카는 이 결과를 지난 6월 유럽 혈액 학회(European Hematology Association,EHA)에서 발표했다.
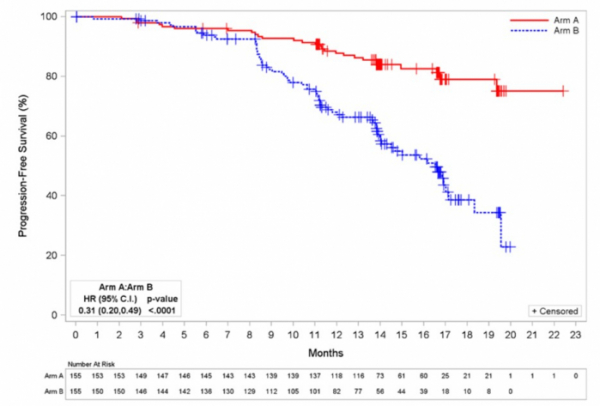
▲ASCEND 임상 PFS 그래프(아스트라제네카 홈페이지 참조)
한편 이번 칼퀸스의 판매승인은 FDA의 실시간 항암제 검토(Real-Time Oncology Review)와 신설된 프로젝트 '오르비스 프로그램(Project Orbis programs)'에 따라 허가됐다. 오르비스는 FDA가 국제 파트너 규제기관과 항암제에 대한 승인 신청을 동시에 검토하는 규제 체계다. 첫번째 케이스인 자궁내막염 치료제로 키트루다(kytruda)+렌비마(lenvima)는 미국, 호주, 캐나다 3개국에서 동시에 승인 받았다. 이번에 칼퀸스는 미국 FDA와 호주 식품의약청(Australian Therapeutic Goods Administration), 캐나다 보건부(Health Canada)가 승인 신청서 검토에 참여했다.







