기사본문
中베이진, 'PD-1 항체' 위식도암 2상 중간결과 '긍정적'
입력 2019-11-27 06:26 수정 2019-11-27 06:30
바이오스펙테이터 서일 기자

중국 베이진(BeiGene)이 자체 개발한 PD-1항체 '티슬레리주맙(tislelizumab, BGB A317)'의 위식도암 임상2상에서 긍정적인 중간결과를 내놨다. 베이진은 지난 23일(현지시간) 싱가폴에서 열린 '유럽의학종양학회(European Society for Medical Oncology, ESMO) 아시아(Asia) 2019'에서 이같은 결과를 발표했다.
티슬레리주맙은 항체 엔지니어링을 이용해 대식세포가 PD-1 항체의 FcγR를 인식해 T-세포를 제거하는 작용을 낮춘 항체치료제다. 베이진은 티슬레리주맙을 불응성/재발성 호지킨림프종과 요로상피세포암 대상 치료제로 개발, 중국에서 신약 승인을 앞두고 있으며, 글로벌 시장에서 간암, 폐암, 위암 치료제로 판매하기 위한 임상 3상을 진행하고 있다.
이번에 발표한 임상 2상(NCT03469557)에는 위/위식도 접합(G/GEJ, gastric/gastroesophageal junction)선암(adenocarcinoma) 환자 15명과 식도편평세포암(ESCC, esophageal squamous cell carcinoma) 환자 15명이 참여했다. G/GEJ선암 환자에게는 티슬레리주맙과 1차 화학치료제인 ‘옥살리플라틴(oxaliplatin)+카페시타빈(capecitabine)’을 병용했고, ESCC 환자를 대상으로는 티슬레리주맙과 ‘시스플라틴(cisplatin)+플루오우라실(fluorouracil, 5-FU)’을 병용했다.
G/GEJ선암 환자는 티슬레리주맙(200mg IV Q3W)과 ‘옥살리플라틴((130 mg/m2 IV Q3W for ≤6 cycles)+카페시타빈(1000 mg/m2, Days 1-15 orally BID Q3W)’을 투여 받았다. ESCC 환자는 티슬레리주맙(200mg IV Q3W)과 ‘시스플라틴(80 mg/m2 IV Q3W for ≤6 cycles)+플루오우라실(800 mg/m2/d, Days 1-5 IV Q3W for ≤6 cycles)’를 투여 받았다. 임상결과는 암 환자의 종양이 치료 중 개선(respond), 동일하게 유지(stable), 악화(progress)되는지를 정의하는 고형암 평가기준(Response evaluation criteria in solid tumors, RECIST)에 따라 분석했다.
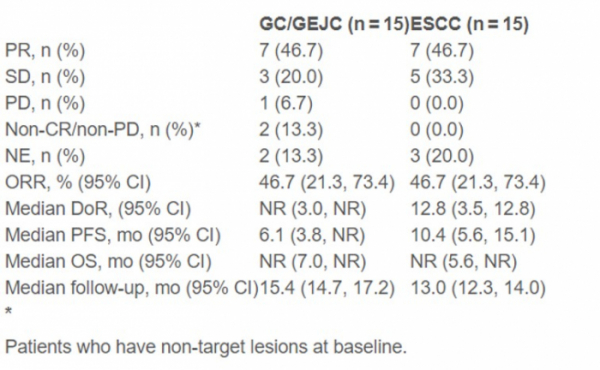
▲티슬레리주맙 임상 2상 결과 요약(베이진 ESMO 발표자료 참조)
분석 결과에 따르면 G/GJE선암 환자 7명(46.7%)과 ESCC 환자 7명(46.7%)이 부분반응(partial response, PR)을 보였고, 각 암 환자군(cohort)에서 전체반응률(objective response rate, ORR)은 46.7%였다. 데이터 컷오프(data cutoff)시점에서 G/GJE선암 환자 4명과 ESCC 환자 4명은 치료받지 않아 데이터 분석에서 제외됐다.
종양이 약에 반응했다가 다시 진행되기까지의 기간을 나타내는 중간반응기간(Median duration of response, DoR)은 G/GEJ선암 환자군은 진행 중이고, ESCC 환자군은 12.8개월이었다.
무진행 생존률(progression-free survival, PFS) 중간값(median)은 G/GEJ선암 환자군 6.1개월, ESCC 환자군 10.4개월이었다.
전체 생존률(overall survival, OS) 중간값(median)은 두 암 환자군 모두 진행 중이었다. G/GEJ선암 환자군 OS는 6개월째 85%, 12개월째 62%이었고, ESCC 환자군은 6개월째 71%, 12개월째 50%를 보였다.
G/GEJ선암 환자군과 ESCC 환자군은 티슬레리주맙+화학치료제 병용요법을 잘 견뎌냈고, 보고된 이상반응(adverse events, AEs)는 PD-1항체 치료제+화학치료제 병용요법에서 기존에 알려진 내약성(tolerability) 프로파일과 일치했다.
모든 환자에서 경도-중증도의 치료-급성 이상 반응(treatment-emergent adverse events, TEAEs)이 발생했다. 가장 일반적인 TEAEs(≥40%)는 빈혈(60%), 식욕감소(56.7%), 구역(53.3%), 무력증(50%) 등이었다. 3~4등급 TEAEs는 11명 환자에서 발생했고 주로 구토(16.7%), 저나트륨혈증(13.3%) 등이었다. 심각한 부작용(Serous AEs)는 13명의 환자에서 발생했고 주로 혈액 빌리루빈 증가, 연하곤란증(dysphagia), 피로(fatigue)를 보였다.
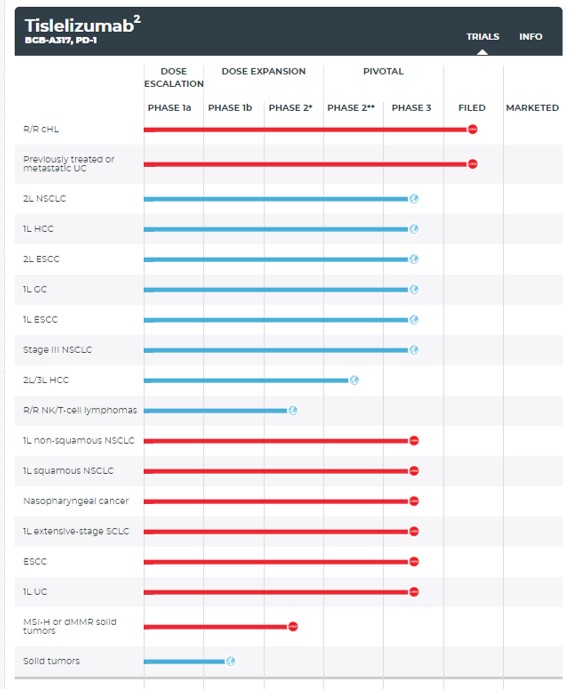
▲티슬레리주맙 임상진행도 (빨간색:중국임상, 파란색:국제임상)(베이진 홈페이지참조)







