기사본문
애브비, 에디타스와 CRISPR 치료제 '파트너십 종결'
입력 2020-08-11 06:15 수정 2020-08-11 06:15
바이오스펙테이터 서윤석 기자

애브비(Abbvie)가 에디타스 메디슨(Editas Medicine)과 CRISPR 치료제 개발 파트너십을 종결했다. 이로써 에디타스는 레베르 선천성흑암시(LCA10)를 포함한 희귀 안질환 CRISPR 치료제 파이프라인의 권리를 회복하게 됐다. 특히, 에디타스의 'EDIT-101'은 체내(in vivo)에서 진행하는 첫 임상 약물이다.
앨러간(Allergan)과 에디타스는 2017년 CRISPR 치료제 후보물질의 개발을 위한 파트너십을 체결해 LCA10 치료제 후보물질 EDIT-101을 비롯해 5개의 CRISPR 약물을 개발하기로 했다. 그러나 애비브가 앨러간을 인수하면서 파트너십을 종결한 것이다.
에디타스는 6일(현지시간) 애브비로부터 레베르 선천성흑암시 치료제 후보물질 'EDIT-101'을 비롯한 CRISPR 약물들의 연구, 개발, 사업화를 위한 모든 권리를 반환받았다고 밝혔다.
희귀 유전질환인 레베르 선천성흑암시(LCA10)는 광수용체의 상실로 인해 발생하는 망막퇴행성질환으로 생후 1살이내의 소아에게 실명을 유발한다. LCA10 환자의 20~30%는 CEP290 유전자돌연변이에 의해 발병한다.
에디타스의 EDIT-101은 CEP290 돌연변이 유전자를 체내에서 교정해 손상된 광수용체를 재생시켜 치료하는 방식으로 생체 내에서 임상을 진행중인 첫 CRISPR 약물이다. 버텍스(Vertex)와 CRISPR 테라퓨틱스(CRISPR Therapeutics)가 겸상적혈구증과 지중해성빈혈 환자를 대상으로 임상을 진행하고 있으나, 이들은 체외(ex-vivo) 방식으로 세포를 편집한 후 환자에게 투여해 에디타스와 차이가 있다.
신시아 콜린(Cynthia Collins) 에디타스 CEO는 "환자에게 투여되는 최초의 생체 내 CRISPR 약물인 EDIT-101을 포함한 안구 프로그램의 완전한 권리를 회복하게 돼 기쁘게 생각한다"며 "현재 임상1/2상(Brilliance, NCT03872479)에서 EDIT-101을 개발하는데 집중하고 있다"고 말했다. 이어 "저용량의 EDIT-101을 투여 완료하고, 올해 말까지 중간용량의 EDIT-101 약물을 적어도 한명에게 투여할 것"이라고 말했다.
한편, 에디타스는 올해 말까지 겸상적혈구증 치료제 후보물질 'EDIT-301'의 임상허가신청(IND)을 진행하고 고형암을 타깃하는 동종유래 NK 세포치료제 후보물질 'EDIT-201'의 전임상 결과를 발표할 계획이다. 에디타스는 2021년 하반기에 EDIT-201의 임상허가신청(IND)을 진행할 계획이다.
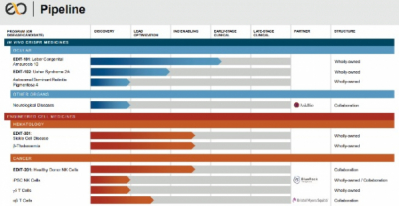
▲에디타스 파이프라인(에디타스 발표자료 참조)







