기사본문
2020 FDA 신약 61건..'블록버스터 or 불발' 살펴보니..
입력 2021-01-06 10:08 수정 2021-01-07 09:17
바이오스펙테이터 노신영 기자
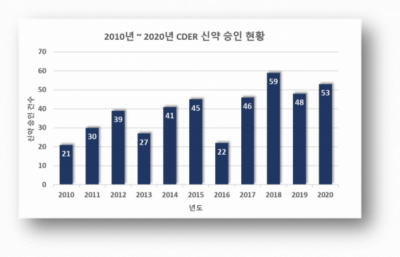
▲2010년부터 2020년까지의 FDA(CDER) 신약 승인 현황 (FDA 참조)
지난 2020년 한해동안 미국식품의약국(FDA)은 산하 의약품 평가연구센터(CDER)가 승인한 신약 53건, 바이오 의약품 평가연구센터(CBER) 승인 바이오신약 8건으로 총 61건의 신약을 승인했다. CDER 승인 수치는 작년 48건과 비교하여 소폭 증가했다. 2010년 21건이었던 CDER 신약승인은 2012년 39건, 2015년 45건, 2017년 46건, 2018년 59건 등으로, 2013년(27건)과 2016년(22건)에는 다소 주춤하기도 했지만 대체적으로 꾸준히 증가하는 추세다.
신약허가 상황을 보면 작년에도 여전히 항암질환이 강세를 보이며 13건의 신약 승인을 받았다. HIV, 에볼라 바이러스 및 기생충 등의 감염질환이 7건, 유전성 희귀질환에 대한 신약이 7건, 혈액암 관련 질환이 4건이었다. 다발성 경화증 및 관련 질환(시신경척수염범주질환, NMOSD)에 대해서도 3건의 신약이 승인되었으며, 신경계 퇴행성 뇌질환인 파킨슨병에 대해서도 1건의 신약 등록이 이뤄졌다. 이외에도 변비, 여드름, 편두통 등 가볍고 일상적인 질환에 대한 신약도 승인되었다.
2020년 CBER 승인 신약 수는 8건으로 2019년 25건(NDA/ANDA 포함)의 3분의1 수준으로 감소했다. 다만 2019년 CBER에 의해 승인된 25건의 신약 중 백신, 면역 글로불린, 유전자 치료제 등 실질적인 치료제에 해당되는 신약은 7건으로 대부분 혈액형 진단 시약에 사용하는 Blood Grouping Reagent나 분석(Assay)용 진단 시약이 승인을 받았다는 것을 감안한다면 큰 차이가 없다. 2020년 CBER 승인 신약 8건 중 3건은 Blood Grouping Reagent로, 나머지 5건이 실질적인 바이오 치료제인 셈이다.
그렇다면 지난해 시장의 관심을 한 몸에 받았던 블록버스터 기대 약물들은 어떻게 되었을까? 코로나를 뚫고 FDA 승인에 성공한 주인공에는 무엇이 있을까? 바이오스펙테이터는 지난 2020년 신약승인을 받은 약물 중 2021년 블록버스터 약물로 예상되는 신약과 2020년 시판에 실패한 블록버스터 기대 약물들을 선정, 이에 대해 알아보았다. 이밖에 지난해 시판허가를 받은 신약 중 주목할 만한 'First-in-Class' 약물, 신속승인 (Accelerated Approval)을 받은 신약 6건 그리고 FDA 승인을 받은 진단 약물 7건에 대해서도 함께 살펴보았다.... <계속>







