기사본문
‘CRISPR-Cas9’ 유전자 가위, 그 무궁무진한 가능성
입력 2016-07-05 13:45 수정 2016-09-23 15:53
바이오스펙테이터 김성민 기자
CRISPR를 얘기하기 전에 먼저 바이러스란 골칫덩이를 알아야 한다. 바이러스는 무생물과 생물의 중간이라고 정의되는데 숙주(Host cell)를 통해서만 자신을 복제할 수 있는 특징이 있다. 바이러스에 감염돼 고통받는 것은 인간만이 아니다. 바이러스는 종류에 따라 세균부터 동물, 식물 세포까지 다양한 숙주에 들어가 ‘자손 번식’이라는 목표를 이룬다.
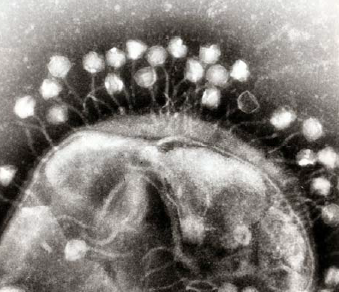
▲숙주세포에 부착한 바이러스 모습
세균을 예로 들어보자. 바이러스는 세균에 침입한 다음 자기 유전체(Genome)를 세균 안으로 삽입한다. 이렇게 들어간 바이러스 유전체는 세균이 가진 시스템을 적절히 이용해 이후 자가 조립에 필요한 유전체와 단백질들을 합성해 증식한 다음 적절한 시기에 세균 죽이고 다른 숙주로 이동한다.
◇CRISPR-Cas9은 원래 세균의 것
세균이 바이러스에 감염되면 용해(Lysis)되기에 세균 입장에서 바이러스는 시한폭탄과 같다. 이에 세균도 바이러스에 대항하여 싸울 수 있는 전략을 세웠다. 바이러스 유전 정보인 DNA가 들어오면 세균의 감시병은 이를 찾아내 자기 유전체 안에 보관해 두는데, 바이러스를 이겨낸 세균은 이 정보를 축적하고 이를 후대에 넘겨주게 된다. 이 유전자 서열에는 이제까지 감염된 다양한 바이러스 DNA가 주기적인 간격으로 분포하고 있어 ‘주기적 간격으로 분포하고 짧은 회문 구조 반복서열(CRISPR, Clustered regularly interspaced short palindromic repeats)’이라 불린다.
CRISPR 시스템은 저장한 DNA로부터 RNA라는 분자 복제본을 만들어낸다. 그러면 감시병이 RNA에 결합해 복합체를 형성하고 자신이 가진 RNA와 DNA를 대조해, 유전체 속에 숨어있는 바이러스성 DNA를 찾아 정확하게 잘라낸다. 이 때문에 바이러스는 세균내에서 증식할 수 없게 되는 것이다. 이러한 중요한 역할을 하는 감시병이 바로 Cas9이라는 단백 분자다. CRISPR-Cas9 시스템은 일종의 ‘바이러스 예방 접종카드’로서 역할을 하는 세균의 적응 면역 체계인 것이다. 또한, CRISPR는 유전체에 위치하기 때문에 다음 세대에 전달할 수 있다.
CRISPR-Cas9 시스템은 DNA를 정확히 자르는 특성 때문에 ‘유전자 가위’라는 별명을 가지고 있다.
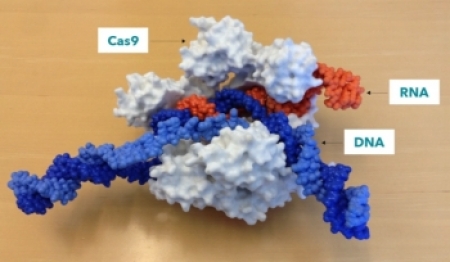
▲Cas9-RNA가복합체가 상보적인 DNA에 결합한 모습
◇유전자를 자르고, 붙이고, 뒤집고
CRISPR 유전자 가위는 ‘Science’ 저널에 2015년 주목할 만한 기술로 선정됐다. 유전자 가위가 이토록 큰 관심을 받는 이유는 무엇일까? 유전자 가위를 다시 한 번 정리하자면 DNA의 특정한 부분을 인지해, 자르면서 DNA 사이에 틈(DSB, Double strand break)이 생기게 된다. 이 현상을 몇 가지 재미있는 유전 공학적 기술로 이용할 수 있다. 특정 유전자를 자르고, 틈에 원하는 유전자를 넣고, 또 바꿀 수도 있다.
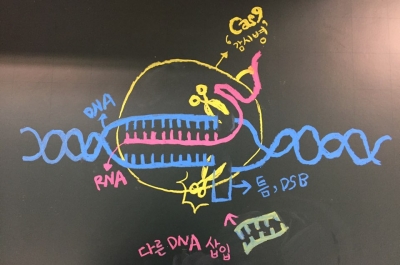
먼저, 원하는 타깃 유전자를 자를 수 있다. 유전자 연구를 할 때 유전자의 기능을 알 수 있는 가장 좋은 방법을 유전자를 없앤 후(KO, Knock-out) 생기는 변화를 보는 것이다. 이론적으로는 간단하지만 실험동물에서 특정 유전자를 없애는 일은 간단하지 않으며 시간이 매우 오래 걸린다. 그런데 CRISPR는 Cas9, guide RNA(자르고 싶은 DNA와 상보적인 서열 조각)만 있으면 1~2주 안에 특정 유전자를 절단할 수 있다.
현재 CRISPR 절단 기술을 이용한 치료 중 가장 앞서 나간 것은 에이즈 치료다. 에이즈는 HIV(Human immunodeficiency virus)에 감염되어 나타나는데, HIV는 CCR5라는 수용체를 통해 인간 세포에 들어간다. 이에 유전자 가위를 이용해 CCR5 유전자의 일부를 잘라 HIV가 수용체에 결합하지 못하도록 막는 방식으로 에이즈를 치료한 시도가 있었다. 실제 Timothy Ray Brown라는 환자에게 이 기술을 적용한 골수를 이식했더니 에이즈가 완치되었다는 보고가 있다.
국내에선 작년 연세대학교 의과대학 약리학교실 김형범 교수팀이 유전자 가위로 RhD+ 혈액형을 RhD- 형으로 바꾸는 데 성공했다.
두 번째로는 원하는 유전자를 넣을 수 있다. 실험적으로는 붙이고 싶은 DNA 조각을 같이 넣어주면 된다. 이 기술을 이용하면 다양한 동식물에서 원하는 단백질을 발현시킬 수 있어 ‘병충해를 견디는 상추’와 같은 개량종을 만들 수 있다.
이 같은 기술은 면역조절 세포치료제를 개발하는 데도 사용될 수 있다. 미국국립보건원(NIH)은 지난 달 21일 CRISPR 기술을 이용해 암세포를 죽이는 살아있는 차세대 약물인 'CAR'를 세포에 도입하는 임상을 승인한 바 있다.
마지막으로는 유전자 서열을 뒤집을 수 있다. 혈우병 발병 원인으로 ‘FVIII’ 유전자 부위가 뒤집힌 경우가 있다. CRISPR 기술을 이용하여 유전자를 다시 정상적으로 돌려놔 혈우병을 치료하겠다는 것이다. 현재 미국 유전자 치료제 임상 기업인 Sangamo BioScience社에서 혈우병 환자 80명을 대상으로 임상시험을 진행 중이다.
툴젠은 혈우병 치료제 전임상을 진행하고 있으며 헌터병, 샤르코마리투스병(CMT) 등 다양한 희귀 질환에 CRISPR 원천 기술을 적용할 계획을 갖고 있다.
김형범 교수는 CRISPR가 다른 유전자를 자를 수 있는 'Off target' 가능성에 대해서 "어디에 부작용이 생길 것인지 어느 정도 예측 가능하다"라고 언급했다.
CRISPR 기술을 이용한 치료제는 근본적인 치료가 가능하며 후손에게 유전병이 전달되지 않는다는 장점을 가진다.







