기사본문
사노피, '보체 저해제' 희귀혈액질환 3상 "1차 충족"
입력 2021-06-17 09:00 수정 2021-06-17 09:00
바이오스펙테이터 서일 기자

사노피(Sanofi)가 지난 11일(현지시간) 한랭응집소증(cold agglutinin disease, CAD) 치료제 후보 물질인 C1s 타깃 단일클론 항체 '수팀리맙(sutimlimab)'이 임상3상에서 1차 종결점을 충족했다고 발표했다. 결과는 9일부터 17일까지 온라인에서 열리는 유럽혈액학회(European Hematology Association, EHA2021 Virtual)에서 구두 발표됐다.
이번에 발표된 임상3상의 파트 A는 이중맹검으로 수팀리맙을 위약과 비교한 임상으로 최근 6개월간 수혈을 받지 않은 환자들을 대상으로 진행됐다(NCT03347422). 42명의 참여 환자들 중 22명은 수팀리맙군, 20명은 위약군에 배정됐다. 환자들은 몸무게에 따라 6.5g 혹은 7.5g의 수팀리맙이나 위약을 투여받았다. 수팀리맙의 장기간 안전성과 반응 지속성(durability of response)을 확인하는 파트 B는 현재 오픈라벨(open-label) 임상으로 진행중이다.
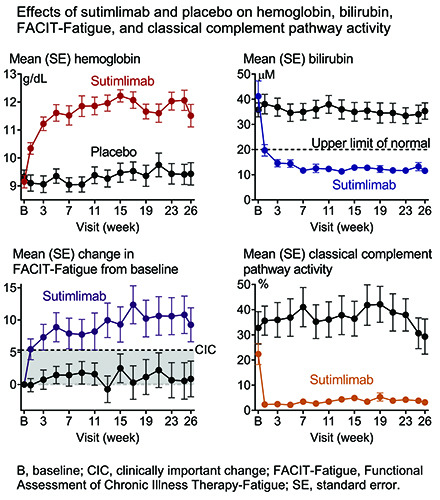
이번 임상3상의 1차 종결점은 평가시점(23주, 25주, 26주)에 헤모글로빈이 1.5g/dL 이상 증가하고, 5주차부터 26주차까지 수혈을 받지 않았으며, 5주차부터 26주차까지 허가받은 것 이외에 CAD 관련 치료를 받지 않은 환자의 비율이었다. 2차 종결점은 헤모글로빈, 빌리루빈(bilirubin), 젖산 탈수화효소(lactate dehydrogenase, LDH) 수준, FACIT-F(functional assessment of chronic illness therapy-fatigue) 점수로 측정된 삶의 질을 포함하는 질병의 주요 표지(key indicators) 개선 평가였다.
이번 임상에서 수팀리맙군 환자 중 16명(73%)이 1차 종결점을 충족했고, 위약군에서는 3명(15%)이 1차 종결점을 충족했다(p<0.001). 수팀리맙군은 평가시점(26주차)에 기준치보다 증가한 평균 헤모글로빈 수치를 보였고, 증가한 수치는 일정하게 유지됐다(p<0.001). 이때 두 그룹간의 평균 차이는 2.6g/dL이었다(최소제곱(least squares) 기준). 수팀리맙군에서 헤모글로빈 수치는 기준치 대비 1주차에 1g/dL 이상, 3주차까지 2g/dL 이상의 평균 증가를 보이며 개선됐다(최소제곱 기준). 수팀리맙군의 전체적인 헤모글로빈 수치는 3주차 이후에 11g/dL 초과로 유지됐다.
수팀리맙은 2차 종결점인 질병의 주요 표지 개선 평가에서도 임상적으로 의미있는 결과를 보였다. FACIT-F 평가로 측정된 피로도 점수는 10.8점(수팀리맙군)과 1.9점(위약군)으로 통계적으로 유의미하게 차이났다(p<0.001). 빌리루빈 감소(-22.1μmol/L vs -1.8μmol/L)와 LDH 수치 감소(-150.8U/L vs +7.6U/L)에서도 수팀리맙군은 위약군보다 나은 결과를 보였다.
위약군 대비 수팀리맙군에서 3명 이상 더 많이 나온 치료관련 부작용(treatment emergent adverse events)은 두통(23% vs 10%), 고혈압(23% vs 0%), 비염(18% vs 0%), 레이노증후군(18% vs 0%) 등이었다. 수팀리맙군에서 3명은 1개 이상의 심각한 치료관련 부작용을 겪었으며, 그 중 당뇨 병력이 있는 환자에게 발생한 뇌동맥 혈전증(cerebral venous thrombosis)은 연구자에 의해 수팀리맙과 관련된 것으로 평가됐다. 두 그룹 모두 사망은 없었다.
CAD는 고전보체경로(classical complement pathway) 활성으로 우리 몸의 면역체계가 적혈구를 공격하는 희귀 만성 자가면역 질환이며, 만성 빈혈, 피로, 급성 용혈위기(hemolytic crisis) 등을 일으킨다. 수팀리맙은 고전보체경로에 있는 C1s를 저해하는 단일클론 항체(monoclonal antibody)이며, C1s 활성화에 따른 CAD 환자의 적혈구 용혈(hemolysis)을 선택적으로 막는다.
카린 노브(Karin Knobe) 사노피의 희귀 질병 및 희귀 혈액장애(Rare and Rare Blood Disorder)부서 대표는 “이번 임상 결과와 2019년 ASH(American Society of Hematology)에서 발표된 이전 임상3상(NCT03347396)의 데이터는 우리가 유럽의약품청(European Medicines Agency, EMA)에 제출할 서류의 근거가 될 것이다”라고 말했다.
한편, 사노피는 지난해 수팀리맙의 이전 임상3상(NCT03347396) 결과를 기반으로 미국 식품의약국(FDA)에 수팀리맙의 생물의약품 허가신청서(Biologics License Application, BLA)을 제출했으나, 위탁생산시설의 결함으로 최종보완요구(complete Response Letter, CRL)을 받았다. 사노피는 이번 임상 발표와 함께 올해 하반기에 다시 BLA를 제출할 계획이라고 밝혔다.
▲수팀리맙 임상3상 결과-위약 대비 질병 주요 표지 변화(EHA2021 Virtual)







