기사본문
셀트리온, AOCC서 '램시마' 장기 안전성∙효능 결과발표
입력 2021-10-14 12:13 수정 2021-10-14 12:13
바이오스펙테이터 서윤석 기자

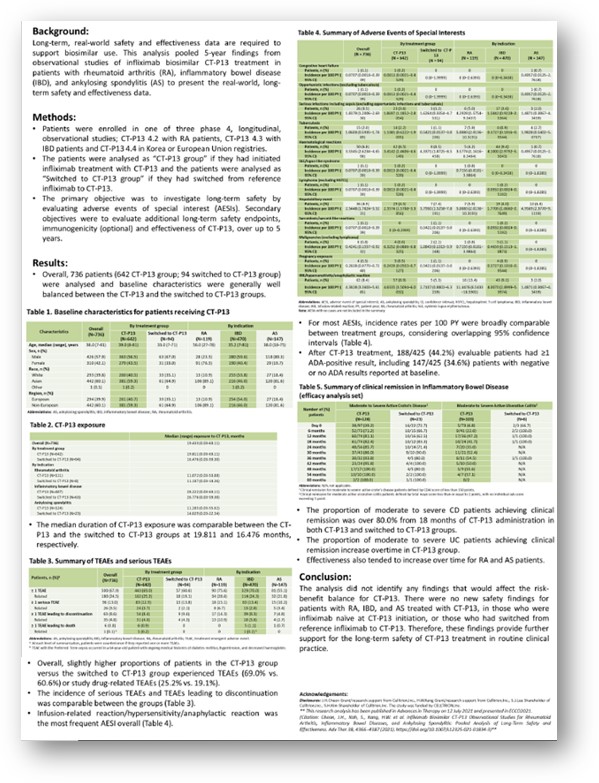
셀트리온은 14일 아시아염증성장질환 학술대회(Asian Organization for Crohn's & Colitis, AOCC)에서 ‘램시마(CT-P13)’ 정맥투여의 장기 안전성과 효능 관찰 연구 최종 결과를 포스터로 공개했다고 밝혔다.
AOCC는 염증성장질환(IBD) 전문가들이 모여 진단 및 치료, 임상에 대한 최신 지견을 공유하는 국제학술대회로 이달 14~16일까지 중국 광저우 현장과 온라인에서 진행된다.
셀트리온에 따르면 램시마 장기연구는 한국 및 유럽 류마티스관절염(RA), 염증성장질환(IBD), 강직성척추염(Ankylosing Spondylitis, AS) 환자 736명을 대상으로 5년간 진행됐다. 램시마를 정맥투여 받은 환자군과 오리지널의약품인 ‘레미케이드’에서 램시마로 전환해 투여 받은 환자군을 장기간 관찰한 결과, 두 그룹 모두 오리지널 의약품 대비 안전성에 특이사항이 나타나지 않았다. 또 면역원성(Immunogenicity)과 유효성(Effectiveness)에서도 두 그룹 모두 차이가 없었다. 이번에 공개한 연구 결과는 올해 7월 국제학술지(Advances in Therapy)에 게재됐다(doi: 10.1007/s12325-021-01834-3).
구체적으로 살펴보면 램시마 투여군은 642명, 전환투여군은 94명으로 약물 투여기간 중간값은 각각 19.8, 16.4개월이었다. 램시마 투여군과 전환투여군에서 나타난 이상반응(TEAEs)은 각각 69%와 60.6%, 약물관련 이상반응은 각각 25.2%와 19.1%로 나타났다.
램시마와 전환투여군에서 가장 흔하게 나타난 특별이상반응(adverse events of special interests, AESI)은 주입부위 반응, 과민성, 아나필락시스 반응 등이었다. 대부분의 AESI는 연간 100명의 환자 발병비율(incidence rates per 100 PY)로 볼때 95% 신뢰구간(CI)에서 겹쳐 유의미한 차이를 나타내지 않았다.
램시마와 전환투여군은 중등도에서 중증 크론병 환자를 대상으로 투여 18개월 후부터 80%이상의 환자에게서 임상적관해(clinical remission)를 보였다. 궤양성대장염(UC) 환자에게서는 전반적으로 램시마 투여군에서 임상적관해가 더 높게 나타났다. 류마티스성 관절염(RA)와 강직성척추염(AS) 환자에서는 램시마 투여군이 전환투여군과 비교해 전반적으로 치료효과가 증가한 경향을 보였다는 설명이다.
셀트리온 관계자는 "램시마는 류마티스관절염, 염증성장질환 등 자가면역질환 환자를 대상으로 한 장기간 임상에서 안전성과 유효성을 다시 한번 입증했다"며 “오리지널 제품과 동등한 효과를 입증한 램시마가 합리적인 가격으로 공급되며 전세계적으로 자가면역질환 치료비용 부담 완화에 기여하고, 투약 편의성을 향상시킨 피하주사 제형 ‘램시마SC’의 글로벌 공급도 가속화되면서 램시마에 대한 환자 접근성은 더욱 향상될 것으로 기대한다”고 말했다.
한편 램시마는 지난 2012년 국내 식품의약품안전처로부터 판매허가를 획득한 후 2013년에 유럽의약품청(EMA), 2016년에 미국 식품의약국(FDA)로부터 판매허가를 받았다. 셀트리온에 따르면 램시마는 현재 유럽시장에 오리지널 제품을 뛰어넘는 점유율(올해 1분기 기준, 51.8%)을 기록하고 있다. 또 지속적으로 바이오시밀러 우호정책을 펼치는 미국에서도 올해 2분기 기준 17.2%의 시장점유율을 달성하며 꾸준한 성장세를 보이고 있다.
(셀트리온 제공)







