기사본문
[BioS 레터]암세포에 구멍 만들어 제거 가능할까?
입력 2021-11-10 12:31 수정 2021-11-10 14:42
정다혜 객원연구원
2013년, Immunity에 ‘The Cancer-Immunity Cycle’이 발표되었다. 바로, 우리 몸에 생긴 암세포가 우리 몸에 있는 면역세포를 통해 제거될 수 있는 과정을 설명한 것이다. 기존의 항암제나 절제 수술법을 통한 암치료법에 새로운 패러다임이 제시된 것이다. 간단하게 소개하면 ①암세포가 사멸하면서 세포 내에 있던 ‘항원(Antigen)’을 방출한다. ②방출된 항원을 ‘수지상세포(Dendritic cells, DCs)가 인지하여 활성화된다. ③활성화된 수지상세포가 림프절로 이동하여 T세포를 활성화한다. ④활성화된 T세포가 혈관을 타고 암 주변으로 모여 암에 표지된 항원을 인식하면서 T세포가 암을 제거한다.
이러한 면역 사이클(Cycle)을 기반으로 우리 몸의 면역세포를 통해 암세포를 죽일 수 있는 다양한 방식들이 나타났고, 이것을 면역 치료제(Immunotherapy)라고 부른다. 면역 치료제에도 다양한 방식이 등장했다. ④단계를 활용하는 면역관문억제제(Immuncheckpoint blockade, ICB)가 있다. 활성화된 T세포가 암 주변으로 왔을 때 암세포가 살아남기 위해 T세포의 활성을 억제하는 단백질을 발현한다. 대표적으로 ‘PD-L1’이 있어 이 PD-L1을 억제하는 항체(Antibody)를 개발하는 방법이다. ③단계를 활용하는 방식으로 CAR-T 치료법이 있다. 암세포를 죽이는 면역세포로 잘 알려진 것은 T세포인데, 이것을 유전적으로 강화시켜서 우리 몸에 다시 넣어주는 방식이다. 또 다른 면역 치료제로서 면역원성 세포사멸(Immunogenic cell death, ICD) 방식이 있다. 이것은 ①단계를 이용하는 것이다.
암세포도 세포 증식이 비조절적으로 일어나고 있는 상태여서 세포에 스트레스가 생기게 된다. 그래서 기본적으로 암세포도 죽게 된다. 이때 죽어가는 암세포 내에 있는 물질들이 방출되어 면역세포가 활성화가 되고, 활성화된 면역세포가 암세포 주변에 모여 면역작용을 통해 암세포를 죽일 수 있다. 이것이 우리가 위에서 얘기했던 면역 사이클의 원리이다. 하지만 암세포의 증식 속도에 비해 스트레스로 죽는 암세포의 양은 상당히 적고, 그만큼 암세포의 주변에 모이는 면역세포의 수도 적을 것이다. 따라서 ICD 방법은 암세포의 죽음을 촉진함과 동시에 더 많은 물질을 방출시켜 면역세포의 활성을 증가시키는 접근법이다.
그렇다면 암세포의 죽음을 촉진하는 방법은 무엇일까? 그리고 암세포의 죽음은 어떤 형태일까?
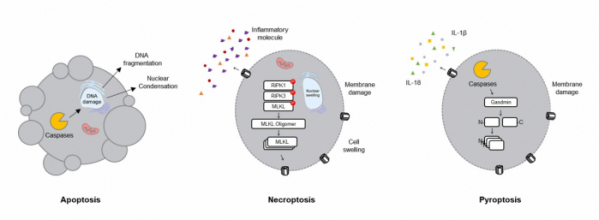
▲그림 1. 세포 사멸의 형태
세포사멸의 형태
◆Apoptosis= 암세포는 정상세포에 비해서 빠르게 분열하면서 성장한다. 그래서 세포가 밀집되는 형태가 생기게 되는데 이때 가장 안쪽에는 산소가 충분히 도달하지 못해 세포가 죽는다. 또한 암세포도 특정 유전적인 돌연변이로 인해 세포의 분열 주기가 과도히 빨라서 세포 자체에 스트레스가 생기게 된다. 이런 상황에서 세포 생장을 유지하는데 중요한 기관 중 하나인 미토콘드리아가 스트레스를 받아 ‘Cytocrome c’를 방출한다. Cytocrome c는 타겟 단백질의 ‘Cysteine’과 ‘Aspartic acid’를 인지해서 절단시킬 수 있는 ‘Cysteine-aspartic proteases(Caspases)’를 활성화하고 이로 인해 DNA가 쪼개지는 ‘DNA fragment’가 일어나고, 세포가 수축(Condensation)하면서 죽는다. 이 형태를 사람들은 ‘Apoptosis’라고 명명하였다. 추후에 실험적인 기법으로 세포 배양하는 동안 ‘Tumor necrosis factor-alpha(TNF-alpha)’를 처리함으로 Caspase가 활성화가 되어 ‘Inhibitor of apoptosis(IAPs)’를 억제함으로 Apoptosis가 유도되는 것을 확인하였다.
◆Necroptosis= 그렇다면 Apoptosis의 Caspase를 억제하면 Apoptosis가 일어나지 않을까? 재미있게도 Apoptosis가 억제됨과 동시에 다른 세포 죽음이 나타났다. Caspase가 억제되면서 ‘Receptor-interacting serine/threonine-protein kinase 1(RIPK1)’이 활성화가 되었고, 그로 인해 ‘Receptor-interacting serine/threonine-protein kinase 3(RIP3K1)’을 불러들이고, 이 ‘RIPK1/RIPK3 복합체’가 ‘Mixed Lineage Kinase Domain Like Pseudokinase(MLKL)’에 인산화를 통해 활성화한다. Apoptosis에서 Caspase가 중요한 것처럼 이 세포 죽음의 형태에서 MLKL은 상당히 중요한 역할을 한다. 바로 활성화된 MLKL이 서로 ‘도메인(Domain)’을 공유하여 ‘올리고머(Oligomer)’를 형성한다. 이 올리고머는 속이 빈 원통 형태로 세포막으로 이동할 수 있다. 세포막으로 이동한 원통형의 올리고머는 세포막에 구멍을 만들게 되고, 그로 인해 세포 내부의 물질들이 밖으로 방출되면서 세포가 죽게 된다. 이 형태를 ‘Necroptosis’라고 하였다. 세포가 수축하면서 제거되는 Apoptosis와는 다르게 Necroptosis의 주요한 특징은 세포 내부의 물질들이 밖으로 방출되는 것이다. 방출되는 다양한 물질들을 ‘Damage-associated molecular patterns(DAMPs)’라고 한다.
◆Pyroptosis= Necroptosis가 발견되고 난 후 새로운 세포 죽음의 형태가 밝혀졌다. 바로 활성화된 Caspase에 의해 ‘Gasdermin(GSDM)’이라는 단백질이 절단되는 것이다. GSDM은 GSDMA, GSDMB, GSDMC, GSDMD 그리고 GSDME로 존재한다. 또한 Caspase도 Capase-1부터 Caspase11까지 존재하는데 특정 Caspase에 의해서만 절단될 수 있는 특성을 토대로 GSDM을 분류한 것이다. 예를 들면 GSDMD는 Caspase-1/4/5/8/11에 의해 절단된다고 있다고 알려져 있다. 절단된 GSDM은 N-말단과 C-말단으로 나뉘게 되는데 N-말단끼리 MLKL처럼 올리고머를 형성할 수 있고, 세포막으로 이동하여 구멍을 만들어 세포 내에 물질들을 방출할 수 있다. Apoptosis처럼 Caspase에 의해 활성화되지만 Necroptosis처럼 세포에 구멍을 뚫는 형태를 나타나 ‘Pyroptosis’라는 이름이 붙었다.
이런 양상에서 Pyroptosis를 통한 ICD를 유도하여 암세포를 제거하고자 하는 노력들이 다양하게 이루어지고 있다.
GSDME가 암세포를 죽일 수 있을까?
2020, Nature에 보고된 ‘Gasdermin E suppresses tumour growth by activating anti-tumour immunity’라는 논문을 소개해보고자 한다.
암세포는 어떤 이유로 발생하는 것일까? 다양한 이유가 있겠지만 한가지의 가설은 바이러스에 감염된 세포가 제대로 제거가 되지 않아 세포에 변이를 일으켜 더욱 빠르게 성장하게 하는 이유가 있다. 그렇다면 위에서 우리가 얘기했던 세포 사멸이 이런 상황에서 제대로 발생하면 제거가 가능할 것인데 암세포에서 그렇지 못한 이유가 무엇일까?
논문의 저자들은 Pyroptosis를 일으키는 중요한 단백질인 GSDM, 그 중 기존의 GSDMD에 비해 상대적으로 덜 알려져있던 GSDME가 ‘메틸레이션(Methylation)’으로 인해 발현이 충분히 이루어지지 못하고 있는 점과 Caspase에 의해 절단된 N-말단 부분에 돌연변이가 다수 존재하는 점을 확인하였다. 따라서 GSDME가 정상적으로 발현하였을 때 암세포에서 Pyroptosis가 충분히 일어나서 암세포를 죽일 수 있을지에 대해 확인하고자 하였다.
먼저 저자들은 GSDME가 기존에 알려진 것처럼 절단되고 세포막에 구멍을 뚫을 수 있는지 확인하였다. 이를 확인하는 방법으로 기존에 GSDME가 Caspase-3에 의해 절단된다고 알려져 있기 때문에 Caspase-3를 빠르게 활성화 시킬 수 있는 ‘Raptinal’이라는 약물을 사용하였다. GSDME를 과발현시킨 세포와 GSDME가 발현하지 않는 세포에 각각 Raptinal을 세포에 처리하였을 때 약 40분만에 Caspase-3가 활성화되는 것을 확인할 수 있었고, 동시에 GSDME의 절단된 것을 확인할 수 있었다.
세포가 Apoptosis가 진행될 때 이중층으로 이루어진 세포막 내부에 존재하는 ‘Phosphatidylserine(PS)’가 세포막 외부로 노출되는 특징이 있다. 그래서 이것의 노출 정도를 확인함으로 Apoptosis가 진행되는 것을 확인할 수 있다. Raptinal을 처리하였을 때 GSDME가 과발현된 세포와 발현하지 않는 세포 모두 PS의 노출이 증가되는 것을 확인할 수 있었다. 하지만 이때 세포 내부로 유입되어 핵을 염색할 수 있는 시약인 ‘Sytox green’을 확인하였을 때 GSDME가 발현하지 않는 세포에서는 ‘Sytox green’의 양이 증가하지 않았다. 또한 이때 세포 내에 존재하고 있는 물질인 LDH가 GSDME가 과발현되어 있을 때 방출된 양이 증가되는 것을 확인할 수 있다.
이 결과를 통해 Caspase-3가 활성화가 되었을 때 Apoptosis와 비교하여 GSDME가 활성화되어 세포막에 구멍을 뚫었다는 것을 의미한다. 이 결과를 토대 실제로 암세포에서 GSDME가 정상적으로 발현한다면 실제로 세포에 구멍을 뚫어 암세포를 제거할 수 있는 것을 시사한다.
GSDME로 구멍을 뚫는 것만으로 암세포가 죽을까?
암세포는 몸 안에서 일어나는 현상이고, GSDME로 인해 Pyroptosis가 유도된다면 세포 내부에 물질들이 방출되어 면역 작용이 일어날 것이다. 따라서 저자들은 이러한 Pyroptosis가 유도되었을 때 면역작용을 통해 암세포가 죽는 것인지를 확인하고자 하였다. 따라서 마우스에 GSDME가 잘 발현하고 있는 세포인 ‘EMT6’와 ‘CT26’를 주입하고, 이 세포에서 GSDME를 ‘녹아웃(Knock out)’시켜 주입하였다. GSDME가 녹아웃된 세포를 주입한 마우스보다 EMT6와 CT26이 주입된 마우스에서 암세포의 크기가 줄어드는 것을 확인하였고, 암세포를 마우스에서 분리하여 암세포 내에 있는 면역세포를 확인하였을 때 훨씬 많은 면역 세포들이 활성화된 것을 확인할 수 있었다. 특히 NK 세포가 높은 수치로 확인되었다.
면역세포가 암세포를 제거하는 방법은 ‘Perforin/GranzymeB 경로’가 잘 알려져있다. 암세포에 발현하고 있는 ‘MHC Class I’과 면역세포의 Receptor가 결합하면 면역세포에서 ‘Perforin’을 통해 암세포의 세포막에 문을 만들어준다. 그리고 ‘Granzyme B’라는 물질을 Perforin을 통해 암세포로 방출한다. 암세포에 유입된 Granzyme B는 Caspase를 활성화시켜 Apoptosis를 일으켜 암세포를 제거한다. 따라서 EMT6와 CT26이 주입된 마우스에서 Perforin과 Granzyme B의 발현을 확인했을 때 두 단백질이 증가되어 있는 것을 확인하였다. 이러한 결과들을 토대로 Caspase-3를 통해 활성화된 GSDME가 세포막에 구멍을 뚫는 것만으로 암세포를 죽이는 것이 아니라 면역세포를 활성화시켜 암세포를 제거하는 것임을 확인하였다.
면역세포를 통해 암세포를 죽이기 위해선 Granzyme B가 잘 알려져 있는데 이 Granzyme B 역시 Caspase 처럼 타겟 단백질의 ‘Serine’잔기를 절단할 수 있는 Protease이다. 따라서 저자들은 Granzyme B를 통해 GSDME가 절단되는지 보고자 하였다. GSDME가 발현하는 세포에서 Granzyme B를 처리하였을 때, GSMDE가 절단되는 것을 확인하였다. 그리고 Raptinal을 통해 활성화된 Caspase-3로 인해 절단된 GSDME의 크기와 같은 크기인 것을 확인하였다. 이러한 결과들을 토대로 Caspase-3로 절단되는 위치와 Granzyme B가 절단하는 위치가 같은 것을 확인할 수 있었다.
ICD 접근법, "암세포 제거 전략의 가능성"
저자들은 GzmB/caspase3를 통해 GSDME를 활성화 시킬 수 있는 점과 동시에 세포 외부에서 다른 약물을 주입하거나 방사선 치료 등(Extrinsic treatment) 없이 몸 안에서 일어나는 현상만으로 암세포를 제거할 수 있는 점을 밝혔다. 따라서 GSDME가 암세포를 제거하는 전략으로서의 가능성을 시사하였다. 하지만 많은 암세포는 GSDME가 Methylation을 통해 억제되어있다. 따라서 Methylation을 억제하는 ‘Decitabine’을 통해 GSDME의 발현을 증가시키는 전략을 제시하였다.
실제로 암환자에게 선행되는 항암제나 수술법에 의해 나타나는 부작용은 이루 말할 수 없다. 하지만 이러한 면역세포를 통한 ICD 접근의 치료가 가능하다면 많은 부작용들을 약화시킬 수 있기 때문에 상당히 주목받고 기대되는 접근법이다.







![[인사]유한양행, 2026년 1월 임원 인사](https://img.etoday.co.kr/crop/268/200/2044634.jpg)