기사본문
아납시, 'IL-36R 항체' 여드름 2상도 "실패"
입력 2022-03-17 08:59 수정 2022-03-17 08:59
바이오스펙테이터 윤소영 기자

아납시(AnaptysBio)의 리드 파이프라인 IL-36 수용체(IL-36R) 항체치료제 후보물질이 이번엔 여드름 임상에서도 실패했다. 지난해 실패한 수장족저농포증(palmoplantar pustulosis, PPP) 임상과 마찬가지로 효능부족 때문이다.
아납시는 14일(현지시간) IL-36R 항체 ‘임시돌리맙(imsidolimab)’으로 진행한 여드름 임상2상에서 위약대비 효능을 확인하지 못한 결과로 임상을 중단한다고 밝혔다.
발표에 따르면 이번 임상은 123명의 중등증~중증 여드름 환자를 대상으로 진행됐으며 환자들은 임시돌리맙 혹은 위약을 피하주사로 투여받았다. 임시돌리맙 투여군은 고용량군과 저용량군으로 나뉘었는데, 고용량군은 임상 첫날 400mg을 투약받고 그 후 4주에 1번씩 200mg을 투약받았다. 저용량군은 첫날 임시돌리맙 200mg을, 그 후 4주에 1번씩 100mg을 투약받았다(NCT04856917).
아납시는 임상의 1차종결점으로 치료 12주차 얼굴의 평균 염증성 병변(여드름) 수의 변화를 측정했다. 그 결과 임시돌리맙 고용량군에서는 6.8개 감소(27% 감소), 저용량군에서는 7.4개 감소(21% 감소), 위약군에서는 9.6개 감소(38% 감소)하며 오히려 위약군에서 더 높은 효능이 나타났다.
2차종결점인 얼굴 IGA(investigator's global assessment) 점수 0점(clear) 혹은 1점(almost clear)을 달성한 환자는 임시돌리맙 고용량군에서 12%, 저용량군에서 0%로 나타났다. 그에 반해 위약군에서 2차종결점을 달성한 환자는 14%로, 역시 위약이 임시돌리맙 대비 더 높은 효능을 보였다.
안전성 측면으로 치료관련 부작용이 나타난 환자는 임시돌리맙 고용량군에서 44%, 저용량군에서 23%, 위약군에서 27%로 나타났다. 심각한 부작용이 나타난 환자들은 각 군에서 1명씩 발생하며 양호한 안전성 결과를 보여줬다.
아납시는 이번 결과에 따라 여드름 임상은 중단하지만 임시돌리맙으로 진행중인 전신농포건선(generalized pustular psoriasis, GPP) 임상3상, 화농성한선염(hidradenitis suppurativa) 임상2상은 계속 진행한다. 화농성한선염 임상2상의 탑라인 결과는 올해 하반기에 나올 예정이다.
함자 수리아(Hamza Suria) 아납시 대표는 “이번 임상 결과가 실망스럽지만 임상에 참여해준 모든 환자, 조사관, 직원들께 감사를 표한다”며 “GPP 임상과 화농성한선염 임상은 계속 진행하겠다”고 말했다.
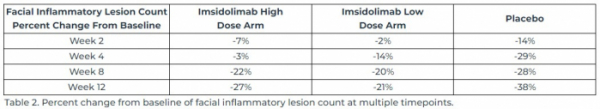
▲'임시돌리맙(imsidolimab)' 여드름 임상2상 결과(아납시 보도자료)
임시돌리맙은 아납시의 리드 파이프라인으로 IL-36 수용체(IL-36R)와 결합하는 단일클론항체다. IL-36은 염증성 사이토카인중 하나로 IL-36R에 결합해 다양한 염증반응을 일으킨다고 알려져 있다. IL-36은 상피조직에서 주로 발현하기 때문에 염증성 피부질환의 중요한 발병 요인이 된다. 이에 아납시는 IL-36R 항체로 염증작용을 억제하는 기전의 임시돌리맙을 염증성 피부질환인 여드름, GPP, 화농성한선염 등의 치료제로 개발하고 있다.
아납시는 지난해에도 임시돌리맙으로 진행한 임상에서 효능 부족으로 실패한 적이 있다. 아납시는 임시돌리맙으로 수장족저농포증(palmoplantar pustulosis, PPP) 임상2상을 진행했는데, 1차종결점으로 본 PPP 증상의 심각도를 측정하는 PPPASI 점수에서 임시돌리맙군, 위약군 점수는 각각 6.1점, 6.3점 감소하며 임시돌리맙은 위약대비 효능을 보여주지 못했다. 다른 지표인 PPPASI50(PPPASI 점수 50% 개선)과 PPPASI75(PPPASI 점수 75% 개선)를 달성한 환자비율은 임시돌리맙군에서 각각 38%, 17%, 위약군에서는 50%, 13%로 나타났다. 이번에 발표한 여드름 임상 결과와 비슷하게 PPP임상에서도 일부 지표에서는 오히려 위약군이 더 좋은 효능을 보인 결과를 나타냈다. 현재 아납시는 해당 적응증으로 임상을 진행하고 있지 않다.
하지만 아납시는 GPP 환자를 대상으로 한 긍정적인 임상2상 결과에 따라 지난해 3분기부터 임상3상을 진행하고 있다. 아납시는 임상2상에서 임시돌리맙을 투여받은 환자의 75%에서 임상적 효능(clinical global impression, CGI)을 확인했다고 설명했다. 하지만 해당 결과는 8명의 환자를 대상으로 한 결과였으며, 임상은 위약대조군이 없는 단일군(single arm) 임상이었다. 이에따라 아납시는 임시돌리맙의 효능 이슈를 잠재우기 위해 GPP 임상3상에서 확실한 효능 결과가 요구되고 있다.







