기사본문
대웅제약, ‘나보타’ 경부근긴장이상 美 2상 “긍정적”
입력 2022-09-27 11:05 수정 2022-09-27 11:05
바이오스펙테이터 서윤석 기자

대웅제약은 파트너사인 이온바이오파마(AEON BioPharma)가 27일 자사 보툴리눔 톡신 ‘나보타(ABP-450)’의 경부근긴장이상(Cervical Dystonia) 미국 임상 2상에서 1차종결점을 충족시킨 긍정적인 탑라인(Topline) 결과를 발표했다.
발표에 따르면 대웅제약의 보툴리눔 톡신 치료사업의 독점 파트너사인 이온바이오파마(AEON Biopharma)는 미국의 20개 기관에서 경부근긴장이상 환자 57명을 대상으로 임상을 진행했다.
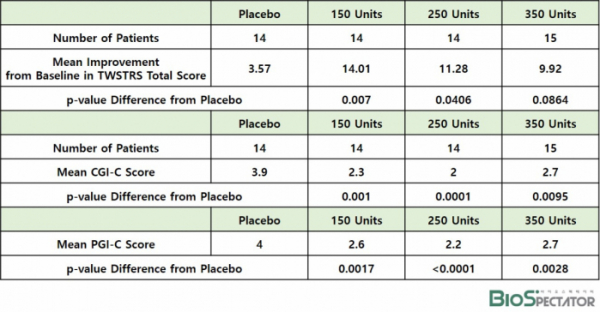
임상에 참여한 환자들은 4그룹으로 나뉘어 저용량(150 U, 14명), 중간용량(250 U, 14명), 고용량(350 U, 15명)의 나보타와 위약(14명)을 투여받았다. 이온바이오는 20주 동안 추적한 결과, 4주차 TWSTRS(Toronto Western Spasmodic Torticollis Rating Scale) 점수는 저용량군 14.01점(p=0.007), 중간용량군 11.28점(p=0.0406), 고용량군 9.92점(p=0.0864)으로 위약 3.67점 대비 개선된 결과를 보였다. TWSTRS 점수는 경부근긴장의 중증도와 치료효과를 평가하는 지표다.
나보타 투여군은 CGI-C(Clinicians Global Impression of Change) 점수와 PGI-C를 위약 대비 통계적으로 유의미하게 개선했다. 나보타 저용량, 중간용량, 고용량 투여군에서 CGI-C 점수는 각각 2.3점(p=0.001), 2.0점(p=0.0001), 2.7점(p=0.0095), PGI-C 점수는 각각 2.6점(p=0.0017), 2.2점(p<0.0001), 2.7점(p=0.0028)로 위약군 각각 3.9점, 4.0점 대비 유의미하게 개선됐다. CGI-C는 의료진이 환자의 건강상태 변화를 측정한 지표이며, PGI-C는 환자가 자신의 변화를 평가한 지표다.
안전성 측면에서 나보타 투여군에서 나타난 부작용은 경증에서 중등도로 일시적이었으며, 심각한 부작용은 나타나지 않았다.
박성수 대웅제약 부사장은 “미국을 필두로 한 선진국의 보툴리눔 톡신 치료시장 진출은 대웅제약이 파트너사와 오랫동안 준비해 온 대표적인 미래 성장동력으로, 긍정적인 2상 탑라인 결과를 발표하게 돼 기쁘다”며 “미국 환자들에게도 나보타를 합리적인 가격에 공급해 미국의 공익에도 부합할 수 있을 것으로 기대한다"고 말했다.
한편 이온바이오파마는 내년 만성 및 삽화성편두통 임상 2상 탑라인 결과를 발표할 계획이다.
(이온바이오파마 자료 참조)







