기사본문
E테라퓨틱스 제론 코미팜 젬백스의 공통점 '텔로미어'
입력 2016-10-06 13:59 수정 2016-10-06 13:59
바이오스펙테이터 조정민 기자
늙지 않는 것은 남녀를 불문하고 누구나 원하는 꿈 같은 얘기다. 아기 때의 탄력 있던 피부는 시간이 지나갈수록 주름이 생겨 거울 속에 비친 모습을 보면 서글프게 만든다.
우리 몸의 노화와 죽음의 비밀을 밝히는 하나의 단서가 있다. '죽음의 타이머' 혹은 '생체시계'라고도 불리는 텔로미어(Telomere)다.
죽음의 타이머 '텔로미어'
우리 몸은 수없이 많은 세포로 이루어져 있고 그 세포의 핵 안에는 유전 정보를 담고 있는 23쌍의 염색체가 존재한다. 이 염색체의 양 끝 단에는 손상으로 인한 퇴화와 유전자의 변형을 방지하기 위한 보호 캡이 있는데 이 것이 바로 말단소체, 텔로미어(Telomere)다.
텔로미어는 ‘TTAGGG’ 라는 염기서열이 1500~2500 개가 반복되는 구조를 하고 있다. 6개의 단백질이 모여 복합체(shelterin complex)를 형성해 염색체의 끝이 서로 합쳐지는 증상 (end-to-end fusion)을 막고 세포의 상태를 파악해 분열을 저지하는 세포주기확인점(cell cycle checkpoint)의 활성화를 억제한다.
세포 분열을 할 때 유전정보를 가진 염색체의 복제가 일어난다. 이 때 DNA 합성효소는 항상 시발제를 필요로 하기 때문에 염기서열의 끝부분까지 완벽하게 복제가 이루어지지 못하고 30~150bp의 염기가 탈락하는 현상이 생긴다. 이로 인해 텔로미어의 염기서열이 탈락하고 길이가 짧아진다.
세포 분열이 발생할 때마다 줄어들다가 지나치게 짧아진 텔로미어는 유전자 보호를 위한 캡 기능을 상실하게 되고 유전자를 다양한 요인(흡연, 음주, 방사선 등)의 충격으로부터 지키지 못하게 된다. 이렇게 손상이 축적되면 세포주기확인점(cell cycle checkpoint)의 활성화가 이루어지고 세포는 노화와 사멸의 수순을 겪게 되는 것이다.
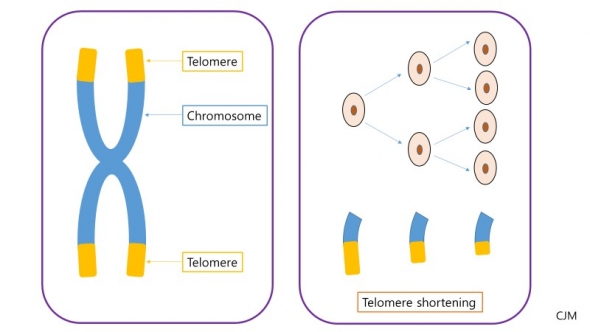
많은 질환의 원인이 되는 텔로미어
문제는 텔로미어가 짧아지는 현상(telomere-shortening)으로 인해 단순히 노화만 진행되는 것이 아니라 다양한 질병의 원인으로 까지 거론되기 때문이다.
영국의 Glenfield 병원의 심장학 교수 N J samani와 그 연구팀은 심각한 심장혈관질환 환자들의 백혈구 DNA에서 텔로미어 길이의 척도로 사용되는 TRF(terminal restriction fragment) 길이가 비교군보다 짧다는 결과를 발표했다. 환자들의 텔로미어 길이는 자신의 연령보다 8.6세 많은 건강한 사람의 텔로미어와 같았다.
제 2형 당뇨병의 경우에도 환자와 비 당뇨인의 텔로미어 길이의 차이가 크다. 이는 췌장의 β세포의 노화와 telomere shortening이 연관 있음을 생각해 볼 수 있다고 연구자들은 말한다.
2012년 미국 NIH의 연구진은 불충분한 조혈 작용과 저세포성 골수로 인한 말초 혈액의 범혈구감소증이 특징인 재생불량성 빈혈의 환자는 같은 연령의 건강한 사람보다 텔로미어의 길이가 확연히 짧다는 연구 결과를 보고했다.
텔로미어와 관련된 질환 중 가장 흥미로운 것을 꼽으라면 암이라고 할 수 있다.
노화와 다른 만성적 질환의 끝에서 일어나는 대부분의 암은 염색체의 불안정으로 인해 유전적 병변이 일어나 세포가 악성의 암세포로 전환되는 것이 원인이다.
노화가 진행되는 과정에서 텔로미어가 짧아지는 것은 암의 위험성이 증가하는 것과 강한 연관성을 가지고 있다. 많은 학술지들은 염색체의 불안정이 암 초기 발생의 유도에 영향을 미친다고 주장한다.
뿐만 아니라 텔로미어가 염색체의 끝에서 보호하는 캡(capping) 능력을 상실하면서 환경적 변화를 유도함으로써 암을 발생시킨다. 체외 실험에서 짧은 텔로미어가 특정 악성종양의 가장 초기 단계의 빠른 진행에 직접적으로 관여한다는 실험 결과가 이 주장을 뒷받침해준다.
반면, 체내에서 생성된 암세포는 대략 50번의 세포 분열을 거치면 노화 혹은 사멸되는 다른 체세포들과 달리 끊임없는 분열이 가능한 특징을 가진다. 이는 텔로미어의 끝에서 부족한 염기서열을 메꿔주는 텔로머라아제(Telomerase)가 분비되기 때문이다.
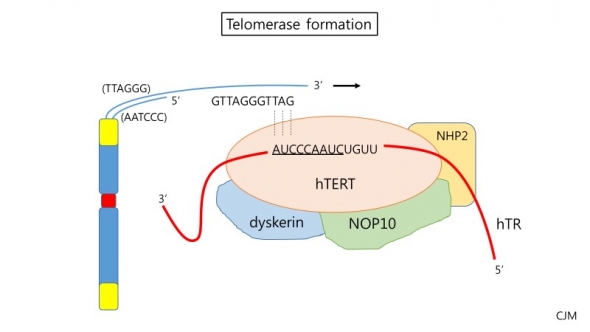
RNA와 단백질의 복합체(RiboNucleoProtein; RNP)인 텔로머라아제는 미처 복제되지 못하고 탈락되는 TTAGGG를 반복적으로 첨가해 텔로미어 길이를 보존하는 역할을 한다. 인간은 배아상태(Embryonic state)에서는 많은 세포에서 텔로머라아제가 발현하지만 그 시기가 지나면 정상인의 경우에는 배아세포, 남성의 생식세포, 재생조직의 증식세포 외에는 발견되지 않는다.
대부분의 암세포는 짧은 텔로미어를 가짐과 동시에 높은 레벨의 텔로머라아제를 분비한다. 그래서 텔로머라아제의 활성화 여부와 텔로머라아제의 구성요소인 hTERT protein, hTR RNA template의 증가 등을 암 진단의 지표로 사용한다.
질환 치료를 위한 텔로미어 연구
2009년 텔로미어와 텔로머라아제를 규명한 엘리자베스 블랙번, 캐럴 그리더, 잭 쇼스택이 노벨상을 수상하면서 텔로미어를 다양한 질환에 적용하기 위한 다각적인 접근이 시도됐다.
텔로머라아제를 발현하지 않는 세포에 hTERT 효소활성부분을 발현시키면 텔로미어의 길이가 보존되면서 계속적인 분열이 가능하다는 실험 보고에 따라 항노화(Anti-aging)에 대한 피부 세포 연구 등에도 적용될 수 있다.
텔로미어 연구 기반의 노화치료 1세대로 활약 중인 빌 앤드루스가 CEO로 재직하는 미국의 생명공학 기업 시에라 사이언스는 오랜 연구 끝에 인체 내 텔로머라아제를 활성화하는 40여종의 화학물질을 찾아낸 상태이다.
또 췌장의 인슐린 분비세포의 노화 및 사멸에 따른 제 2형 당뇨병의 경우, 텔로머라아제를 발현시켜 β세포의 세포 분열을 촉진하는 방법으로 체내의 인슐린을 보충하는 연구가 진행중이다.
2016년 두바이의 'Eastern Biotech & life science'사는 개인의 텔로미어 길이 측정과 함께 심각하게 짧은 텔로미어에 대한 양적화가 가능한 Telomere analysis test를 선보였다. 이 회사는 이 기술이 질병의 조기 진단과 위험도 판별, 그리고 생활습관으로 인한 심혈관질환, 당뇨병 등의 치료에 도움이 될 것이라고 설명했다.
가장 활발하게 적용, 연구되고 있는 분야는 암 치료 분야이다.
텔로머라아제가 과도하게 발현하는 암세포의 특성상 텔로머라아제 억제제(Telomerase inhibitor)는 치료제로서 높은 가치를 지닌다. 높은 특정성(Specificity)을 가지는 것은 물론 일반의 체세포에는 거의 영향을 주지 않으므로 암 치료제의 부작용의 측면에서도 장점을 가진다. 다만 텔로머라아제가 발현하는 재생 조직의 증식 세포와 남성의 생식세포 등에서 원하지 않는 억제 효과가 나타날 수 있다.
영국의 신약개발 회사인 'E-therapeutics'는 텔로머라아제의 조절과 발현에 관련한 다양한 네트워크를 타깃으로 한 small molecule ETS-2300을 개발, 전임상을 진행 중이다.
미국의 Geron의 Imetelstat(GRN163L)은 텔로미어의 RNA template에 작용해 합성을 방해함으로써 텔로머라아제를 억제하는 기전의 항암제이다.
전임상 데이터 구축을 위해 10가지의 췌장암 세포에서 GRN163L을 지속적으로 노출시킨 이후 암세포의 세포 분열과 세포주기, 텔로미어의 길이, 텔로머라아제의 활성도 등을 관찰했다. 그 결과 GRN163L이 일정 농도로 체내에 존재할 때, 암세포의 세포 분열 횟수가 제한되고 성장이 억제되는 것을 확인했다.
Geron은 수술 이후 암세포의 재성장을 억제하는 효과를 기대할 수 있으며 전임상 자료를 바탕으로 임상을 진행하여 체내 적정 농도를 위한 용량과 안전성을 확인하기 위해 준비하고 있다.
국내의 기업에서도 텔로미어와 텔로머라아제를 대상으로 한 암 치료제 연구가 진행되고 있다.
코미팜에서 임상을 진행 중인 코미녹스는 'sodium metaarsenite'를 주 효능성분으로 하는 비소계 항암제로 텔로미어 길이가 짧은 암세포에 대해서 높은 항암 효과를 발휘한다.
회사 측은 텔로머라아제 억제제의 경우, 텔로미어의 alternative lengthening으로 무효화 되는 경향이 존재하지만 코미녹스는 직접 텔로미어에 결합해 소실을 유도하고 이를 통해 암세포의 노화와 사멸을 촉진해 높은 치료 효과를 보인다고 전했다. 전임상의 동물 모델에서 뛰어난 항암 효과를 확인하였고 그 결과를 참고하여 현재 미국에서 폐암에 대한 임상2상을 진행중이며 호주에서는 지난 9월 7일,호주 시장 내의 코미녹스 공급 허가를 획득했다.
국내에서는 고형암과 담도암, 간암 등의 적응증에 대해 임상을 진행 중에 있다.
젬백스앤카엘은 hTERT의 active site에 해당하는 염기서열을 가진 펩타이드 GV1001을 이용해 면역을 활성화하는 면역 항암제를 개발 중이다.
암세포가 분비하는 텔로머라아제의 구성요소인 hTERT의 염기서열 중 일부를 펩타이드 백신으로 제작해 체내에 주입하면 수지상세포(Dendritic cell)의 세포막 단백질 MHC 에 항원 표지물질로 작용해 CD8+ T cell과 CD4+ T cell의 면역 반응을 활성화 시킨다. 이 활성화된 면역세포와 면역 항체는 암세포에 특정적으로 작용하여 공격, 세포 사멸을 유도한다.
젬백스는 체내에서 발견되는 이오탁신(Eotaxin)을 바이오마커로 규명, 혈중 이오탁신의 농도가 높은 환자를 대상으로 임상시험을 한 결과 생존기간이 현저하게 상승했음을 확인했다.
GV1001을 적용한 면역 항암제 리아백스주(RIAVAX)는 이를 바탕으로 국내 판매허가를 받았으며, 국소진행성 및 전이성 췌장암 환자를 대상으로 Gemcitabin/Capecitabine과 병용투여 후의 안전성과 유효성을 확인하기 위한 다기관 평행설계 임상3상을 진행 중이다. 회사 측은 GV1001의 확장 적용을 위해 전립선 비대증 대상으로 국내 임상 2상을 진행중이며 17년 2분기에 임상 3상을 계획하고 있다. 또 알츠하이머와 관련된 전임상 자료를 축적하고 있으며 국내와 미국에서의 임상을 준비중이다.







