기사본문
AZ '타그리소' 임상3상 결과, 폐암 2차치료제 효과 확인
입력 2016-12-07 15:40 수정 2016-12-10 15:38
바이오스펙테이터 김성민 기자
올해 한미약품이 베링거인겔하임에 기술수출했다가 임상이 중단된 '올무티닙'의 경쟁약으로 주목받았던 변이성 비소세포폐암 치료제인 아스트라제네카 '타그리소'가 기존 화학요법 대비 뛰어난 종양억제 효과를 보이면서 다시한번 선도약물로써 입지를 다졌다.
아스트라제네카가 미국 기준 6일 밝힌 타그리소(성분명: 오시머티닙)의 2차 치료제 효과를 확인하기 위한 임상3상(ARUA3) 결과에 따르면 기존 백금착체 항암제 대비해 무진행 생존기간(PFS, progression-free survival)이 5.7개월 향상(10.1개월 vs 4.4개월)해다고 밝혔다.
또한 34%의 중추신경계 전이 환자에서는 무진행 생존기간이 화학요법 대비 4.3개월 늘어나(8.5개월 vs 4.2개월) 우수한 효능을 확인했다.
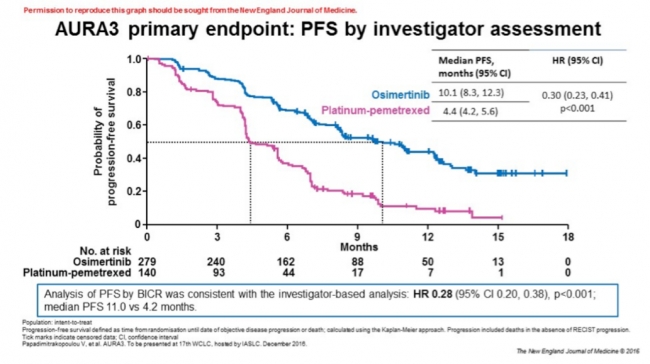
▲ARUA3 무진행 생존기간(PFS) 결과출처: 회사제공
2차 평가항목(secondary endpoint)인 객관적 반응률(objective response rate, ORR)에서도 기존 약과 대비해 우수한 효능(71% vs 31%)을 확인했다. 전체생존기간(Overall survival ,OS) 결과는 아직 도출되지 않았다.
ARUA3는 변이성 비소세포폐암 중 EGFR(상피세포성장인자수용체, Epidermal growth factor receptor) T790M 양성 환자군 419명에서 진행했으며, EGFR 1차 치료를 받고 더 이상 효과를 나타내지 않은 경우다
미국 텍사스대학 M.D. 앤더슨 암센터의 바실리키 A. 파파디미트라코풀루 박사는 “이번 ARUA3 결과는 통계적으로 유의미할 뿐만 아니라 타그리소가 화학요법을 대체하는 첫번째 약이라는 것에 임상적 의미를 갖는다"라며 "특정 비소폐암 환자군에 새로운 기회를 제공할 수 있으며, 폐암 치료가 한걸음 나아갔다는 것을 보여준다"라고 전했다.
업계 애널리스트에 따르면 향후 타그리소의 시장 가치가 연간 최대 3조원에 다다를 것으로 평가하고 있다. 또한 현재 3세대 EGFR TKI치료제가 없기에 빠르게 기존 시장에 침투할 것이라는 전망이다.
타그리소는 2015년 FDA승인을 받은최초의 3세대 EGFR TKI 계열 약물로 이후 유럽, 일본, 캐나다, 스위스 등에서 EGFR T790M 변이 양성 비소세포폐암 치료제로 판매승인을 받았다. 국내에서도 올해 5월 식약처로부터 시판 허가를 획득했다.
비소세포폐암을 비롯한 일부 암에서 EGFR에 생긴 변이로 인해 EGFR이 과활성화된 상태로 유지되는 것이 문제로 작용한다. 이레사, 타세바와 같은 1세대 EGFR TKI(tyrosine kinase inhibitor)는 수용체의 타이로신 카이네즈를 억제함으로써 EGFR의 활성을 낮추겠다는 전략이다.
그러나 폐암의 80%를 차지하는 비소세포폐암에 쓰이는 1세대 타세바, 이레사는 EGFR 활성에 영향을 주는 물질로 약효는 좋지만 투약 후 1년 내에 높은 내성을 가진다는 큰 한계점을 지닌다. 이때 내성 환자 중 50%이상에서 발현되는 T790M 돌연변이가 나타나는 환자를 대상으로 큰 시장 잠재성을 갖고 있기에 많은 제약사들이 T790M 양성 환자군을 타깃하는 약물을 개발중이다.







