기사본문
[남궁석의 신약연구史]'콜레스테롤'의 발견
입력 2018-09-04 10:27 수정 2018-09-04 10:29
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
이제 그동안 다루었던 항암 신약의 개발 역사를 떠나서 다른 신약의 개발 과정에 대해서 알아보도록 한다. 그렇다면 어떤 질환을 대상으로 하는 약물의 개발 역사를 다룰 것인가? 그 이전에 21세기를 사는 우리의 생명을 위협하는 질병은 어떤 것이 있는지부터 알아보도록 하자. 과연 현대인은 어떤 질병에 의해서 가장 많이 목숨을 잃고 있을까? 미국 질병관리본부(Central Disease Control and Preventions, CDC)의 통계자료에 의하면 2015년 271만명의 미국인이 목숨을 잃었으며, 그 사인은 심장질환(Heart disease) 63만명, 암(Cancer) 59만명, 만성 하기도 질환(Chronic lower respiratory diseases) 15만명, 사고사 14만명, 뇌혈관질환 14만명, 알츠하이머병 11만명 등의 순이었다[1]. 한편 한국의 경우 2016년 현재 암, 심장질환, 뇌혈관질환, 폐렴, 자살, 당뇨병의 순이었다[2]. 국가에 따라서 다소의 차이가 있지만 심장질환과 암이 현대인에서 사망 원인의 1,2위를 다투는 질환임은 쉽게 알 수 있다.
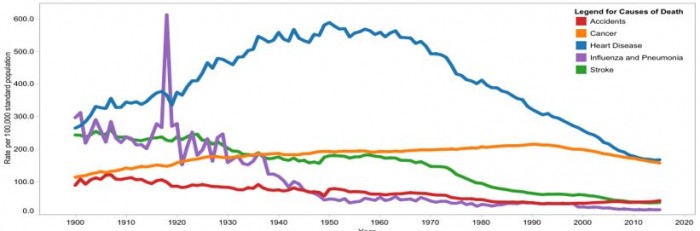
▲그림 1 : 1900년부터 2015년까지 미국의 주요 사망율 변화 추세 (인구 10만명당 사망수). 1900년에는 인플루엔자나 페렴 등의 감염성 질환이 가장 큰 사망원인이었으나, 이는 공중보건의 발전 및 항생제의 개발 등으로 점차 줄어들었고, 대신 1940년 이후에 심장질환이 가장 큰 사망요인으로 대두되었다. 그러나 1960년 이후부터 심장질환에 의한 사망율은 점차 줄어들었고, 이제는 암과 거의 비슷한 수준의 사망율이 되었다. 출처 https://www.cdc.gov/nchs/data-visualization/mortality-trends/index.htm
그렇면 이러한 추세는 이전에도 동일했던가? CDC의 이전 통계자료를 보면 흥미로운 변화를 엿볼 수 있다. 가령 1900년대의 가장 많은 사망을 냈던 질병은 폐렴 혹은 인플루엔자, 그 다음은 결핵 등으로 주로 감염에 의한 전염병에 의한 사망이 가장 많았다. 그러나 이러한 추세는 공중보건의 발전과 항생제의 등장 등으로 급속히 변하게 되었다. 1980년에 이르면 심장질환, 암, 뇌혈관질환 순으로 가장 많이 사망하는 원인이 바뀌게 된다. 이러한 전체적인 추세는 현대에도 이어지고 있으나 여기에는 중요한 차이가 있다. 가령 1980년 미국 기준 심혈관 질환으로 사망하는 사람은 인구 10만명당 507명으로, 2위인 암의 240명에 비해 월등히 많았다. 그러나 2014년이 되자 암의 경우 10만명당 192명의 사망으로 다소 감소한 반면, 심혈관 질환으로 사망하는 사람의 수는 252명으로 절반으로 줄었다. 이러한 추세는 미국뿐만 아니라 유럽에서도 공통적으로 관찰되었다. 과연 1980년과 2014년 사이에 어떤 일이 일어난 것일까?
물론 심혈관질환의 위험요소에는 흡연, 고혈압, 콜레스테롤, 비만, 운동부족과 같은 수많은 요소가 관련되어 있으며, 전체적인 심혈관질환 사망율의 급격한 감소에는 이러한 위험 요소의 감소와, 치료기술의 발전 등 여러가지 요소가 기여하고 있다[3]. 2007년의 연구에 따르면 치료기술의 발전은 사망율 감소에 약 47% 의 기여를 하였으며, 위험요소의 감소가 약 44%의 기여를 한 것으로 추정되고 있다. 이러한 위험요소의 감소 중 혈중 콜레스테롤의 감소(24%), 수축기 혈압의 감소(20%), 금연(12%) 등이 큰 역할을 하였다고 추정되고 있다[4]. 흥미있는 것은 그 기간동안 심혈관질환의 중요한 위험 요소인 비만과 당뇨의 발생 빈도는 증가하였다는 것이다. 심혈관질환의 다른 위험요소가 증가되는 와중에서도 심혈관질환의 사망율이 감소한 것은 치료기술의 발전과 콜레스테롤 혹은 혈압 등을 감소시켜 심혈관질환의 위험요소를 낮출 수 있다는 것을 잘 보여준다.
신약연구사의 제2부에서는 바로 혈중 콜레스테롤 수준이나 혈입 등 심혈관질환의 위험요소의 감소에 직접적인 기여를 한 약물들이 어떤 과정을 통해서 개발되었고, 이것이 심혈관질환의 사망율 감소에 어떻게 유의미한 영향을 미쳤는지의 과정을 알아보도록 하자. 그러나 약물 자체의 등장과정도 있지만, 이러한 약물들이 이전에 어떠한 연구를 기반으로 하여, 어떤 시대적 환경과 맥락에서 등장하였는지를 이해하는 맥락에서 개발되었는지를 이해하는 것이 중요할 것이다.
동맥경화증(arteriosclerosis)과 죽상경화(atheroclerosis) 연구의 역사
동맥경화증(arteriosclerosis)은 동맥의 탄력이 떨어지거나 동맥에 혈전 등이 생기는 등의 이유로 동맥이 좁아지는 질병이다. 동맥경화증의 한 형태로 구분되는 죽상경화(atheroclerosis)는 혈관벽 내에 콜레스테롤이나 내피세포 등이 쌓여 혈관이 좁아지는 질환으로써 관상동맥에서의 심근경색이나 허혈성 뇌혈관 질환의 주요 원인이다. 흔히 죽상경화증을 현대의 영양과잉에 의해 증가한 현대질병으로 생각하는 통념이 있다. 그러나 놀라운 것은 죽상경화증의 증거는 고대 이집트의 미이라나 고대 페루인과 같은 산업혁명 이전 인류의 미이라에서도 발견된다는 것을 볼 때 동맥경화증/죽상경화증을 단순히 영양 과잉에 의한 ‘현대 질병’으로 규정하는 것은 무리일 것이다[5].
최초로 동맥경화증(arteriosclerosis)이라는 용어를 문헌에 남긴 사람은 프랑스의 외과의이자 병리학자인 진 롭스타인(Jean Lobstein, 1777-1835)이다. 그는 1733년 그의 저작에서 관상동맥의 석회화 병변(Calcificated arterial leison)을 관찰하고 이를 ‘arteriosclerosis’ 라고 명명하였다.한편 독일의 병리학자 펠릭스 마찬드(Felix Jacob Marchand, 1846-1822)는 1904년 경화된 동맥 안에서 관찰된 지방축적물을 기술하기 위하여 그리스어로 ‘죽’ 에 해당하는 “athero”와 “굳어짐”을 의미하는 ’sclerosis’를 합쳐 ‘atherosclerosis’, 즉 죽상경화증이라는 용어를 최초로 도입하였다[6]
그렇다면 죽상경화증과 심혈관 질환과의 관계는 언제부터 인식되기 시작되었는가? 협심증(狹心症 /Angina Pectoris), 즉 심근에 산소를 공급하는 관상동맥이 좁아져서 통증을 느끼기 시작하는 증상은 18세기부터 알려져 있었다. 그러나 이러한 증상이 어떤 이유로 나타나는지의 원인에 대해서는 미지수였다. 1912년 미국의 의사 제임스 헤릭(James B Herrick,1861-1954)은 관상동맥이 점진적으로 좁아지는 것이 협심증의 원인이 될 수 있다는 주장을 발표하였다[7].
한편 1844년 덴마크의 신고전주의 화가 베르텔 토르발센이 덴마크 왕립극장에서 심근경색으로 급사하였다. 그의 갑작스러운 죽음의 원인을 밝히기 위한 부검에서 오늘날 죽상경화증의 이해에 중요한 여러가지 증상이 관찰되었는데, 그의 죽음은 좌측 관상동맥에 존재하는 죽상경화판이 갑자기 파열하여 쏟아져 나온 죽상물질들이 동맥을 막아버렸기 때문으로 판명되었다. 그렇다면 죽상경화판과 죽상물질의 정체는 무엇일까?
1852년 독일의 병리학자 루돌프 피르호(Rudolf Virchow, 1821-1902)는 혈관 내에 지방물질이 축적된다는 것을 발견하였다. 그는 단순히 지방물질의 축적을 죽상경화증의 원인으로 보지는 않았다. 후세에 ‘세포병리학’(Cell Pathology)의 창시자로 알려져 있는 그는 혈관 내의 손상이나 감염에 의해서 혈장 내의 지방의 투과성이 증대되고, 이로 인해 혈관에 죽상경화판과 죽상물질의 축적이 이루어진다고 보았다. 그러나 피르호가 죽상경화증에 대해서 가졌던 놀랄만큼 현대적인 아이디어에도 불구하고, 당대의 학자들은 일단 피르호가 발견한 죽상경화증에 존재하는 지방의 축적에 좀 더 초점을 맞추어 연구하게 되었다. 1910년 독일 화학자 아돌프 윈다우스(Adolf Windaus)는 죽상경화증의 죽상물질에는 정상적인 대동맥보다 25배나 더 많은 콜레스테롤이 존재한다는 것을 관찰하였다. 따라서 죽상물질에 축적되는 지방물질의 정체는 바로 콜레스테롤임을 확인하였다.
러시아의 의사 이그나토우스키는 1908년 토끼에게 동물성 단백질이 풍부한 사료를 급여하자 대동막에 세포가 축적되는 것을 확인했다. 그 이후 1913년 러시아의 병리학자 니콜라이 아니츠코프는 토끼에 순수한 콜레스테롤을 급여함으로써 인위적으로 관상동맥에서 죽상경화증과 유사한 현상을 유발시킬 수 있다는 것을 관찰하였다. 물론 이 실험이 인간에서의 콜레스테롤의 섭취가 동맥경화증으로 이어진다는 증거로 바로 해석하기에는 여러가지 어려움이 있었다. 즉 초식동물인 토끼에서의 대사는 분명히 인간과 차이가 있을 것이고, 토끼에서 발견된 병변이 인간 죽상경화증 환자에서 발견된 것과 완전히 일치하지는 않았기 때문이다. 그러나 이러한 연구 결과들은 적어도 죽상경화증에서의 콜레스테롤의 역할에 대해서 연구자들이 관심을 가지게 된 계기가 되었다.
콜레스테롤의 발견
콜레스테롤은 1758년 프랑스의 의사 프랑소와 폴레티어 데 라 살레(François Poulletier de la Salle, 1719-1788)에 의해 담석에서 최초로 분리되었다. 이 물질에 현재의 이름이 붙게 된 것은 이로부터 30년 뒤 프랑스 화학자 미셀 쉐브렐(Michel E Chevrel, 1786-1889)에 의해서였다. 콜레스테롤의 분자식, 즉 콜레스테롤이 어떤 원소에 의해서 구성되어 있는지는 1888년에 이미 결정되었지만, 4개의 고리로 이루어진 콜레스테롤의 구조가 해명되는데는 30년의 세월이 더 필요했고, 1920년대에 아돌프 윈다우스와 그의 동료 하인리히 위에랜드(Heinrich O. Wieland, 1877-1957)는 콜레스테롤의 구조를 제시하였고, 이 공로로 1928년 노벨 화학상을 수상한다. 그러나 재미있는 것은 아돌프 윈다우스가 제시한 콜레스테롤 구조는 1932년 X선 결정학의 선구자격인 존 데스몬드 버날(John Desmond Bernal, 1901-1971)의 분석 결과와 맞지 않는다는 것이 밝혀졌고[8] 윈다우스와 위에랜드는 제대로 수정된 콜레스테롤의 구조를 제시하게 되었다.

▲그림 2 : (좌) 콜레스테롤의 구조식. 콜레스테롤의 존재는 이미 18세기부터 알려져 있었지만 4개의 고리형 구조로 되어 있는 콜레스테롤의 구조가 정확히 규명되는 것은 20세기 초반에서였다. (우) 초기 콜레스테롤 연구의 선구자들. 콜레스테롤이라는 이름을 처음 붙인 미셀 쉐브렐 (Michel E Chevrel, 좌상단), 죽상경화증 환자의 죽상물질에 콜레스테롤이 존재한다는 것을 밝힌 아돌프 윈다우스 (Aldolf Windaus, 우상단), 혈액 중에 지단백질 복합체와 콜레스테롤이 존재함을 확인한 미셀 마체보우프 (Michel Michebouef, 좌하단), 초원심분리기를 이용하여 혈중 지단백질이 밀도가 낮은 저밀도 지단백질 (LDL)과 밀도가 높은 고밀도 지단백질 (HDL)로 나뉜다는 것을 확인하였으며 이의 혈중 농도 측정법을 개발한 존 고프만 (John Goffman).
그렇다면 혈액 중에 콜레스테롤이 존재한다는 것은 언제 알려지게 되었는가? 현재의 우리는 콜레스테롤이 혈액 중에서 지단백질(lipoprotein) 복합체를 형성하여 존재한다는 것을 알고 있다. 이것이 처음 알려지게 된 것은 1929년 프랑스의 파스퇴르 연구소에 근무하던 연구자인 미셀 마체보우프(Michel Macheboeuf, 1900-1953)라는 연구자에 의해서였다. 그는 소 혈청에 있는 단백질을 황산암모늄(ammonium sulfate) 처리에 의해 침전시켜서 분리해 보았다. 이 처리로 분리된 단백질은 59%가 단백질로 구성되어 있었으나 41% 는 지질로 이루어져 있었고, 41%의 지질은 18%의 콜레스테롤과 23%의 인지질로 구성되어 있었다[9]. 그리고 단백질 성분은 알파-글로블린(alpha-globlin)이었다. 이렇게 분리된 지단백질 복합체는 오늘날 고밀도 지단백질(High-density lipoprotein), 약자로 HDL로 더 많이 알려진 것이다.
2차 대전 발발 이후에 전쟁에서 수혈의 수요가 많아지고, 혈액을 구성하고 있는 단백질에 대한 연구 역시 활발해지게 되었다. 혈액 중에 있는 알부민(albumin)이나 감마 글로블린(gamma-globlin)과 같은 단백질은 환자의 치료를 위해서 많이 소요되었다. 이들을 대량으로 확보하기 위한 연구를 통해서 혈액중에 있는 단백질을 분리하는 연구가 많이 진행되었다. 그 와중에서 분리된 지단백질은 기존에 알려진 지단백질 복합체(오늘날 HDL로 알려진)와 성분이 달랐다. 그중 23%의 단백질, 30%의 인지질, 8%의 유리 콜레스테롤과 39%의 콜레스테롤 에스테르가 포함된 지단백질 분획이 있었다. 이것이 오늘날 알려진 저밀도 지단백질(Low-density lipoprotein), 즉 오늘날 많은 사람들이 혈중 지방 농도의 주된 지표로 사용되는 LDL로 알려진 지단백질 복합체가 처음 등장한 배경이다. 그러나 당시의 지단백질의 분리 방법은 매우 번거롭고 시간이 많이 걸리는 방법이었으므로 많은 사람들의 관심을 끌지 못했다.
1946년 버클리 대학의 젊은 연구자인 존 고프만(John Gofman, 1918-2007)은 2차 대전 이후 상용화된 최신 연구기기인 초원심분리기(Ultracentrifuge)를 이용하여 인간 혈청내에 존재하는 단백질을 측정하고 분리하는 연구를 수행한다[10]. 고프만은 초원심분리기를 통하여 LDL의 경우 밀도 1.06 에서, HDL의 경우에는 밀도 1.21에 상응하며, 혈액 중의 각각의 농도는 초원심분리기를 약 한시간 정도 돌리는 것으로 측정가능하다는 것을 알게 되었다. 기존의 침전법에 의한 방법으로는 혈액 중의 LDL과 HDL을 분리는 가능했지만 정확히 측정하는 것은 어려웠지만, 초원심분리기를 이용하여 혈액중의 LDL과 HDL의 농도를 비교적 간편하게 측정할 수 있게 된 셈이다.이러한 그의 연구는 당시에는 큰 주목을 받지 못했지만 2차대전 이후 혈중 콜레스테롤과 심혈관 질환에의 관계가 주목되면서 그의 연구 방법은 매우 중요한 연구 도구로 사용되게 된다.
다음 연재에서는 실제로 콜레스테롤, 그리고 LDL이 어떻게 심혈관 질환, 특히 죽상경화증의 위험 인자로 인식되게 되었는지의 과정을 알아보고자 한다.
참고문헌
https://www.cdc.gov/nchs/data-visualization/mortality-trends/index.htm
2016년 사망원인통계, 통계청
Mensah, G. A., Wei, G. S., Sorlie, P. D., Fine, L. J., Rosenberg, Y., Kaufmann, P. G., ... & Gordon, D. (2017). Decline in cardiovascular mortality: possible causes and implications. Circulation research, 120(2), 366-380.;
Ford, E. S., Ajani, U. A., Croft, J. B., Critchley, J. A., Labarthe, D. R., Kottke, T. E., ... & Capewell, S. (2007). Explaining the decrease in US deaths from coronary disease, 1980–2000. New England Journal of Medicine, 356(23), 2388-2398
Thompson, R. C., Allam, A. H., Lombardi, G. P., Wann, L. S., Sutherland, M. L., Sutherland, J. D., ... & Vallodolid, C. M. (2013). Atherosclerosis across 4000 years of human history: the Horus study of four ancient populations. The Lancet, 381(9873), 1211-1222.
Mayerl, C., Lukasser, M., Sedivy, R., Niederegger, H., Seiler, R., & Wick, G. (2006). Atherosclerosis research from past to present—on the track of two pathologists with opposing views, Carl von Rokitansky and Rudolf Virchow. Virchows Archiv, 449(1), 96-103.
Herrick, J. B. (1912). Certain clinical features of sudden obstruction of the coronary arteries. Trans Assoc Am Phys, 27, 100.
Bernal, J. D. (1932). Crystal structures of vitamin D and related compounds. Nature, 129(3251), 277.
Olson, R. E. (1998). Discovery of the lipoproteins, their role in fat transport and their significance as risk factors. The Journal of nutrition, 128(2), 439S-443S.
Gofman, J. W., Lindgren, F. T., & Elliott, H. (1949). Ultracentrifugal studies of lipoproteins of human serum. J Biol Chem, 179(2), 973-979.







