기사본문
[남궁석의 신약연구史]2차대전후 급증한 죽상경화증
입력 2018-09-28 13:12 수정 2018-09-28 14:55
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
2차 세계대전 이후 심장질환은 미국과 같은 선진국에서 가장 높은 비율의 사망원인 질병으로 떠올랐다. 여기에는 여러가지 요인이 있는데 일단 항생제의 도입과 공중보건의 개선으로 20세기 초에 가장 높은 비중을 차지했던 감염성 질환에 의한 사망율이 낮아진 것이 하나의 요인이다. 또 다른 이유로는 전쟁에서 흡연을 시작했던 수많은 제대 군인들에 의해서 흡연율이 높아졌고, 지방이 풍부한 음식물이 흔해졌다. 그리고 일터의 자동화와 자동차 보급의 증가로 인해서 운동량이 줄어들고 비만이 증가하였다. 이와 같은 여러가지 복합적인 요소들에 의해서 미국에서 가장 많은 사망을 낳는 질병이 되었고, 이에 따른 경각심도 높아지게 되었다. 따라서 이전에는 단순히 노화에 의한 현상이라고 치부되었던 죽상경화증에 대한 관심 역시 높아지게 되었고, 여기에 대한 연구도 활발해졌다.
이번 연재에서는 이렇게 2차 세계대전 이후 부쩍 높아진 죽상경화증을 비롯한 심혈관 질환에 대한 관심에 따라서 진행된 여러가지 연구들에 대해서 소개하고자 한다.콜레스테롤 연구에서 중요한 역할을 한 유전성 고콜레스테롤증(Familial hypercholesterolemia)에 대해서 알아보고, 나중에 LDL(Low-density lipoprotein)과 혈중 콜레스테롤 농도와 죽상경화증간의 관계가 주목되게 된 직접적인 계기가 된 생화학적 연구와 여러가지 역학 연구를 소개할 것이며, 마지막으로 콜레스테롤의 생합성 경로가 발견되는 과정을 알아볼 것이다.
유전성 과다콜레스테롤증(Familial hypercholesterolemia, FH)
혈중 콜레스테롤의 수준과 심혈관 질환과의 상관관계를 처음으로 제시한 것은 가족성 고콜레스테롤혈증(Familial hypercholesterolemia)의 연구였다. 19세기 말부터 피부 바로 아래 지방이 집적되어 형성되는 황색종(Xanthomas)의 사례가 보고되었다. 그러나 이러한 황색종이 어떤 기전을 통하여 형성되는지는 잘 알려지지 않았다[1].
1939년 노르웨이의 내과의사인 칼 뮬러(Carl Muller)는 근친혼이 많이 발생하는 노르웨이의 고립 커뮤니티에서 황색종 형성, 고콜레스테롤혈증 및 심장질환이 빈번하는 17가계를 조사하여 76건의 사례를 분석하였다. 이러한 분석을 통하여 그는 이러한 질환이 유전적으로 유전되는 이상임을 확인하였고, 지방의 집적이 협심증 및 심근경색의 원인이라는 것을 제시하였다[2].
그리고 그 이후의 후속 연구를 통하여 가족성 고콜레스테롤혈증은 하나의 유전자의 이상에 의해서 일어나는 단일 유전자성(monogenic) 유전질환이라는 것이 밝혀졌으며, 존 고프만은 1952년 그가 개발한 초원심분리기를 이용한 LDL 정량법을 이용하여 가족성 고콜레스테롤 환자는 전체 콜레스테롤 및 LDL 의 콜레스테롤 수치가 정상인에 비해 2-5배 높은 수준임을 확인하였다[3]. 그렇지만 가족성 고콜레스테롤혈증을 유발하는 유전자 이상은 어떤 유전자에 위치하는지가 알려지기까지는 1970년대까지 기다려야 했다(결과적으로 LDL 수용체로 알려진 유전자가 가족성 고콜레스테롤혈증의 원인 유전자로써 알려지는 과정에 대해서는 다음 화에서 소개할 것이다). 그러나 가족성 고콜레스테롤증에서 나타나는 것처럼 과다한 콜레스테롤과 심혈관 질환과의 강력한 상관 및 연관 관계에도 불구하고, 혈중 콜레스테롤과 심혈관 질환과의 인과관계가 학계에서 바로 받아들여지지는 않았다. 그 이유라면 가족성 고콜레스테롤혈증에서 증가되는 콜레스테롤 수준은 정상인에 비해서 5-10배까지 높은 수준이며, 해당 유전병 환자가 아닌 일반적인 대중에서 그 정도의 높은 수준의 혈중 콜레스테롤 농도를 가진 사람을 찾기 힘든 상황에서, 과연 어느정도 혈중 콜레스테롤이 존재해야만 심혈관 질환에서의 위험 요소로 작용하는지를 이해하기는 쉽지 않았고, 따라서 가족성 고콜레스테롤혈증에서의 결과를 바로 일반 대중에 적용해서 이야기하기는 힘들었기 때문이다.
결국 콜레스테롤과 심혈관질환, 특히 죽상경화증과의 관계는 실제 일반 대중에서의 혈중 콜레스테롤 수준을 측정하고 이것과 심혈관 질환의 위험도를 살펴본 뒤에야 정립되게 되었다.
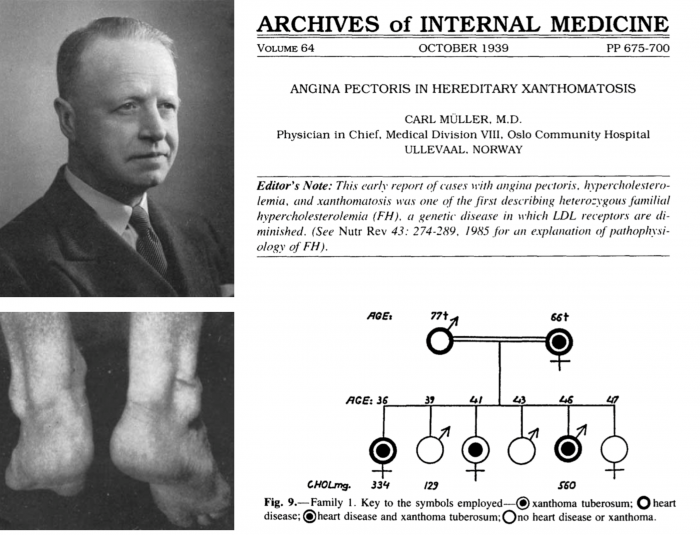
▲그림 1 : 가족성 고콜레스테롤혈증과 심혈관질환과의 관계를 처음 보인 노르웨이의 의사 칼 뮬러 (Carl Müller)와 그의 논문에 나온 환자. 피부에 지방이 집적되어 형성되는 황색종 (Xanthomas)가 관찰된다. 가계도 분석을 통하여 황색종 증상과 심장질환의 발생이 같이 연관된다는 것을 확인하였다.
LDL과 죽상경화증과의 관계
지난회의 연재에서 초원심분리기를 이용하여 혈중 LDL을 분리하고 이 양을 정량화하는 방법을 개발한 버클리대학의 존 고프만(John Gofman)은 이후의 연구에서 죽상경화증과 LDL간의 관계를 살펴보았다. 우선 그는 20세기 초반 러시아의 니콜라이 아니츠코프가 수행한 것처럼 토끼에게 콜레스테롤을 먹이고, 그가 개발한 초원심분리기를 이용한 방법으로 LDL과 HDL의 혈중 농도를 측정하였다. 그 결과 콜레스테롤을 먹인 실험동물에서 LDL 농도가 증가하였으며, LDL 농도가 증가한 실험 동물군에서 죽상경화증의 증상이 심하게 나타나는 것을 발견하였다. 그는 당뇨 환자와 심근 경색 환자를 포함한 약 285명의 사람 혈중 LDL 농도 분석을 통하여 연령대가 증가할수록, 그리고 심근 경색 환자일수록 혈중 LDL 농도가 높다는 것을 확인했다[4]. 그는 이러한 결과에 근거하여 혈중 LDL 농도와 HDL 농도에 따라서 죽상경화증의 위험도가 결정된다는 것을 수치화하는 ‘동맥경화지수’(Atherogenic Index, AI)라는 지표를 1956년 발표하였다[5].
그러나 고프만의 연구는 수백명 이내 작은 실험군을 대상으로 한 연구였고, 좀 더 확실한 결론을 내기 위해서는 훨씬 더 많은 사람을 대상으로 하는 연구가 필요했다. 그러나 당시 매우 귀했던 초원심분리기를 이용하여 수천명 이상의 많은 사람을 대상으로 보다 확실한 결론을 내기 위해서는 많은 연구비가 소요되었고, 고프만은 NIH에 연구비를 신청하였으나 그의 연구비 신청은 거절되었다. 그러나 그는 20세기 미국 의과학 연구 후원및 로비스트로 유명한 매리 래스커(Mary Lasker, 1900-1994, ‘래스커 상’이 바로 이 사람을 기념하여 제정된 상이다)의 주선으로 하버드대 공중보건학, 피츠버그대, 클리블랜드 병원과 버클리대가 함께 공동연구를 할 수 있게 되었고, 이들은 4개 연구소가 협력하여 약 5000명의 중년 남성을 대상으로 혈중 콜레스테롤 농도와 LDL 콜레스테롤의 농도가 심혈관 질환과 상관관계가 있다는 결과를 도출하였다[6]. 물론 이 연구에는 한계가 있었는데, 고프만은 연구 도중 그의 LDL 정량법에 문제가 있어서 정확한 수치가 측정되지 않음을 확인하고 이를 개선하여 자신의 버클리대학에서 얻은 결과는 보정할 수 있었으나 다른 연구팀의 결과는 이미 연구가 진행되어 버려서 보정할 수 없었다. 그 결과 버클리에서 얻은 데이터에서는 혈중 전체 콜레스테롤의 농도보다는 LDL 콜레스테롤 농도가 심혈관 질환과 더 높은 상관관계가 있다는 결론을 얻었지만, 다른 3개 기관의 결과에서는 전체 콜레스테롤 농도와 LDL 콜레스테롤 농도 중 심혈관 질환의 발생 빈도와 더 상관관계가 있는지가 불확실하였다. 어쨌든 고프만의 연구는 혈중 콜레스테롤 농도 혹은 LDL의 양이 심혈관질환 발생 빈도와 뚜렷한 상관관계가 있다는 것을 처음으로 제시해 준 중요한 연구라는 의의가 있다.

▲그림 2: 분석용 초원심분리기 (Analytical Ultracentrifuge) 와 이를 이용하여 혈액중의 LDL 콜레스테롤 농도의 측정법을 개발한 존 고프만 (John Gofman). 그는 자신의 테크닉을 이용하여 심근경색 환자의 경우 정상인에 비해서 혈액 중의 LDL 콜레스테롤 농도가 높다는 것을 확인하여 최초로 LDL 콜레스테롤과 심근경색간의 관계를 제시하였다.
안셀 키스(Ancel Keys)의 ‘7개국 연구’ 등 역학연구에 의해 밝혀진 심혈관 질환과 혈중 콜레스테롤의 관계
미네소타 대학의 영양생리학자인 안셀 키스(Ancel Keys, 1904-2004)는 2차대전 이후 미국 회사 중역과 같이 영양상태가 좋은 사람에서는 심혈관 질환의 발생이 높은 반면[7], 식량부족 현상을 보였던 2차대전중 유럽에서는 심혈관 질환의 발생율이 급격히 감소했다는 데이터에 주목했다.
그는 이러한 데이터를 통하여 식생활이 심혈관 질환에 영향을 줄 것이라는 가설하에 서로 다른 식생활 패턴을 가진 다른 국가를 대상으로 식생활, 혈중 콜레스테롤, 심혈관 질환의 발생 빈도를 조사한다. 즉, 미국, 핀란드, 네덜란드, 이탈리아, 그리스, 유고슬라비아, 일본과 같이 다른 문화권으로 다른 식생활과 라이프스타일 패턴을 가진 나라에서 심혈관 질환의 위험요인에 대한 영향을 인구 집단 수준에서 조사한 것이다. 흔히 ‘7개국 연구’(The Seven Country Study, SCS)라고 불리는 이 연구는 1만2,763명의 40-59세 남성을 7개국의 16개국 코호트에서 혈중 콜레스테롤 농도와 식단을 조사하고 심혈관 질환에 의한 사망율을 10년간 추적 조사하였다. 1965년 단행본으로 발간된 연구에서 크게 2가지 요소가 심혈관 질환의 사망률과 밀접한 관련이 있음이 밝혀졌다[8]. 즉 국가별 혈중 콜레스테롤 농도와 포화지방산 섭취량이 사망률과 매우 높은 상관관계가 있다는 것이다.
물론 안셀 키스의 7개국 연구는 사회적으로 많은 반향을 일으켰지만 학계에서 이 연구가 아무런 반발없이 받아들여진 것은 아니었다. 일단 안셀 키스의 연구에서 보인 식품으로의 포화지방 섭취와 심혈관 질환 사망율간의 연관 관계를 곧바로 인과관계로 해석하는데는 여러가지 문제가 있었다. 그리고 다양한 인종간의 유전적 차이, 그리고 집단간의 생활습관의 차이, 혈압, 비만 등등 여러가지 교란 변수가 존재했다. 또한 7개국 연구에서 심혈관 질환의 발생 빈도는 상대적으로 낮지만 콜레스테롤이나 포화지방을 많이 섭취하는 프랑스와 같은 국가를 의도적으로 제외한 것이 아닌가 하는 문제제기도 있었다. 키스의 연구팀은 여기에 대해서 프랑스와 독일의 경우 2차 세계대전 도중 및 전후의 식량 부족을 심하게 경험한 나라로써 연구가 시작되던 1955년 당시에 이들 나라의 데이터에는 여러가지 문제가 있으며, 프랑스의 데이터를 의도적으로 생략한 것이 아닌 프랑스의 연구팀의 참여를 요청하였으나 프랑스 연구팀의 참여 거부로 데이터에 수록되어 있지 않았다는 반박을 하였다[9]. 어찌되었든 포화 지방 섭취와 심혈관 질환 위험 증가에 대해서는 안셀 키스의 연구가 개시된 지 60년이 지난 현재까지도 논쟁이 완전히 종결되지 않고 있는 상황이다.

▲그림 3: 미네소타 대학의 영양생리학자 안셀 키스 (Ancel Keys)는 다른 식습관과 생활패턴을 가진 7개국의 16개 코호트를 대상으로 한 연구를 통하여 혈중 콜레스테롤의 농도와 포화지방으로부터 얻는 칼로리가 심혈관 질환에 의한 사망과 연관관계가 있다는 것을 보였다. 이러한 연구를 근거로 안셀 키스는 심혈관질환을 식단 조절에 의해서 예방할 수 있다는 주장, 즉 ‘지중해 식단’ (Mediterranean diet) 에 의한 심혈관 질환 예방을 설파하였다.
그러나 안셀 키스의 연구 이외에도 NIH 주관으로 매사추세츠주 프라밍헴(Framingham) 주민들을 대상으로 진행된 프라밍햄 심장 연구(Framingham Heart Study)와 같은 역학연구를 통해서 혈중 LDL 콜레스테롤의 수준, 연령, 흡연여부가 심혈관 질환의 중요한 위험요소(Risk facotrs)로 작용한다는 것이 입증되었다[10]. 따라서 적어도 혈액 중의 전체 콜레스테롤, 혹은 LDL 콜레스테롤의 수준이 심혈관 질환과 상관관계가 있다는 것은 1960년대 말에 이르러 받아들여지기 시작하였다.
콜레스테롤의 생합성 경로 규명
콜레스테롤에 대한 관심이 높아진 2차대전 이후, 콜레스테롤의 생합성이 생체 내에서 어떤 대사경로를 통하여 이루어지느냐에 대한 관심 역시 높아졌다. 특히 1930년대에 콜레스테롤의 복잡한 고리 경로가 알려졌으나 어떻게 이러한 복잡한 구조가 형성될 수 있는지에 대한 화학 경로 자체가 미지수였다.
최초로 콜레스테롤을 구성하고 있는 탄소가 아세트산(acetic acids)으로부터 기인할 수 있다는 것을 확인한 연구자는 콜롬비아 대학의 콘라드 블로흐(Konrad E Bloch)와 데이비드 리텐버그(David Rittenberg)였다. 이들은 1942년 JBC에 발표된 논문에서 중수소로 표지된 동위원소 아세트산을 쥐에 급여하면 콜레스테롤에 아세트산 유래의 동위원소가 들어가지만, 동위원소 프로피온산, 부틸산, 숙신산, 피루브산 혹은 다른 지방산을 먹여도 콜레스테롤에 동위원소가 들어가지 않는 것을 보고하였다[11]. 결국 콜레스테롤을 구성하는 탄소는 아세트산에서 기인한다는 것이다.
일련의 연구를 통하여 콜레스테롤을 구성하는 탄소 원자들은 아세트산이 중합되어 이소프레노이드 전구체를 통하여 스쿠알렌(Squalene)이라는 분자를 형성하고, 이것이 고리화 반응을 일으켜 스테롤 분자의 고유한 특징인 고리구조가 형성되는 것이 1950년대에 이르러 확인되게 되었다[12]. 그리고 각 화학단계를 촉매하는 효소들이 속속 발견되었다.
이 중에서 콜레스테롤 생합성 단계에서 전체 생합성 과정의 속도를 결정하는 단계인 속도 결정단계(rate-limiting step)는 3-히드록시-3-메틸글루타릴-CoA(HMG-CoA)가 환원되어 메발로닉산으로 전환되는 단계이며, 이 단계를 거친 탄소는 스테롤 생합성 경로로 들어가게 되는 첫번째 분기점을 거치게 된다. 많은 생합성 경로와 마찬가지로 이 단계는 생합성을 결정하는 중요한 단계로써 이 과정은 HMG-CoA 환원효소(HMG-CoA reductase)가 촉매한다. 대부분의 생합성을 결정하는 단계의 효소와 마찬가지로 HMG-CoA 환원효소 역시 전사(Transcription)나 번역(Translation) 단계 등 효소 생성 단계 및 이미 형성된 효소의 단백질 인산화를 통한 조절을 받게 된다. 중요한 것은 바로 이 효소가 이후의 연재에서 알아볼 스타틴(Statin)이 그 활성을 저해하는 타깃이 된다는 것이다.
![▲그림 4: 콜레스테롤의 생합성 경로[13] 콜레스테롤은 아세틸-CoA (Acetyl-CoA)의 연속적인 중합으로 스쿠알렌 (Squalene) 이라는 대사 중간체가 되고, 스쿠알렌은 스쿠알렌 모노옥시게나아제 (Squalene Monooxygenase)나 라노스테롤 합성효소 (Lanosterol Synthetase) 등의 반응에 의해서 고리화되어 콜레스테롤의 직접적인 전구체인 라노스테롤이 되고, 이는 후속 반응에 의해서 콜레스테롤 등의 스테롤계 물질이 된다. 3-HMG-CoA가 메발론산 (Mevalonate)이 되는 것을 촉매하는 HMG-CoA 환원효소 (HMG-CoA Reductase)는 전체 생합성 반응의 속도를 결정하는 속도 결정단계 (Rate-limiting step) 이 된다. 스타틴 (Statin)은 바로 HMG-CoA 환원효소를 억제한다.](http://img.etoday.co.kr/pto_db/2018/09/700/20180927104318_1252958_2074_3362.png)
▲그림 4: 콜레스테롤의 생합성 경로[13] 콜레스테롤은 아세틸-CoA (Acetyl-CoA)의 연속적인 중합으로 스쿠알렌 (Squalene) 이라는 대사 중간체가 되고, 스쿠알렌은 스쿠알렌 모노옥시게나아제 (Squalene Monooxygenase)나 라노스테롤 합성효소 (Lanosterol Synthetase) 등의 반응에 의해서 고리화되어 콜레스테롤의 직접적인 전구체인 라노스테롤이 되고, 이는 후속 반응에 의해서 콜레스테롤 등의 스테롤계 물질이 된다. 3-HMG-CoA가 메발론산 (Mevalonate)이 되는 것을 촉매하는 HMG-CoA 환원효소 (HMG-CoA Reductase)는 전체 생합성 반응의 속도를 결정하는 속도 결정단계 (Rate-limiting step) 이 된다. 스타틴 (Statin)은 바로 HMG-CoA 환원효소를 억제한다.
어쨌든 1960년대에 이르러 콜레스테롤 및 혈중 LDL 콜레스테롤의 농도가 심혈관질환과 상관관계가 있다는 여러가지 근거가 도출되었고, 콜레스테롤이 생체 내에서 어떤 과정을 통하여 생합성되는지 등 콜레스테롤에 대한 많은 정보가 도출되었다. 다음 연재에서는 1970년대 이후의 조셉 골드스테인과 마이클 브라운의 LDL 리셉터와 콜레스테롤 조절기전에 대한 연구를 소개하고자 한다.
참고문헌
1. Steinberg, D. (2005). Thematic review series: the pathogenesis of atherosclerosis. An interpretive history of the cholesterol controversy: part II: the early evidence linking hypercholesterolemia to coronary disease in humans. Journal of lipid research, 46(2), 179-190.
2. Muller, C. (1939). Angina pectoris in hereditary xanthomatosis. Archive of Internal Medicine, 64, 675-700
3. McGinley, J., Jones, H., & Gofman, J. (1952). Lipoproteins and xanthomatous diseases. Journal of Investigative Dermatology, 19(1), 71-82.
4. Gofman, J. W., Lindgren, F., Elliott, H., Mantz, W., Hewitt, J., Strisower, B., ... & Lyon, T. P. (1950). The role of lipids and lipoproteins in atherosclerosis. Science, 111(2877), 166-186.
5. Gofman, J. W. (1956). Serum lipoproteins and the evaluation of atherosclerosis. Annals of the New York Academy of Sciences, 64(4), 590-595.
6. GOFMAN, J., Hanig, M., Jones, H. B., Lauffer, M. A., Lawry, E. Y., Lewis, L. A., ... & Andrus, E. C. (1956). Evaluation of serum lipoprotein and cholesterol measurements as predictors of clinical complications of atherosclerosis: report of a cooperative study of lipoproteins and atherosclerosis. Circulation, 14, 691-742.
7. Keys, A., Taylor, H.L., Blackburn, H., Brozek, J., Anderson, J.T., and Simonsen, E., 1963. Coronary heart disease among Minnesota business and professional men followed fifteen years. Circulation, 28 (9), 381-395.
8. Keys, A. (1980). Seven countries. A multivariate analysis of death and coronary heart disease. Harvard University Press.
9. Ancel Keys and the Seven Countries Study: An Evidence-based Response to Revisionist Histories, WHITE PAPER. Commissioned by The True Health Initiative http://www.truehealthinitiative.org/
10. Kannel, W. B., Dawber, T. R., Kagan, A., Revotskie, N., & Stokes, J. (1961). Factors of risk in the development of coronary heart disease—six-year follow-up experience: the Framingham Study. Annals of internal medicine, 55(1), 33-50; Wilson, P. W., Garrison, R. J., Castelli, W. P., Feinleib, M., McNamara, P. M., & Kannel, W. B. (1980). Prevalence of coronary heart disease in the Framingham Offspring Study: role of lipoprotein cholesterols. The American journal of cardiology, 46(4), 649-654.
11. Bloch, K., & Rittenberg, D. (1942).On the utilization of acetic acid for cholesterol formation. Journal of Biological Chemistry, 145, 625-636.
12. Bloch, K. (1965). The Biological Synthesis of Cholesterol. Science, 150(3692), 19–28. doi:10.1126/science.150.3692.19
13. Cerqueira, N. M., Oliveira, E. F., Gesto, D. S., Santos-Martins, D., Moreira, C., Moorthy, H. N., ... & Fernandes, P. A. (2016). Cholesterol biosynthesis: a mechanistic overview. Biochemistry, 55(39), 5483-5506.







