기사본문
[기고]노벨 화학상, '파아지 디스플레이'의 혁신성
입력 2018-10-22 14:27 수정 2018-10-22 14:40
박영우 와이바이오로직스 대표

▲박영우 와이바이오로직스 대표
2018년 노벨 화학상은 효소, 펩타이드 및 항체를 박테리오파아지 (bacteriophage, 이하 파아지라 함)의 표면에 발현시키는 기술 즉 파아지 디스플레이(phage display)에 수여되었다. 처음부터 기초연구보다는 응용연구를 염두에 둔 기술이 노벨 화학상을 수상하게 된 이유는 무엇일까? 답은 파아지 디스플레이 기술의 산업적인 파급효과가 매우 크다는 점이다.
효소, 펩타이드 및 항체의 공통점은 단백질이다. 생물체가 살아가는데 필요한 모든 기능을 담당하는 물질이 단백질이고, 단백질은 DNA로 구성된 유전물질의 산물이다. DNA는 비교적 단순한 구조로 되어있으나 이로부터 생성된 단백질은 매우 복잡한 구조로 되어있다. 그동안 DNA 분석기술은 엄청난 속도로 발전되어온 반면 단백질 분석기술은 큰 기술적 발전이 없었다.
생물학적 현상을 대변하는 단백질의 연구를 대량으로 동시에 고속 연구할 수 있도록 해주는 기술이 바로 파이지 디스플레이 기술이다. 기술의 핵심은 단백질과 단백질을 코딩하는 DNA의 일대일 연결이라 할 수 있다. 파이지 디스플레이의 기술적 파급효과는 3가지 단백질중에서 가장 산업적으로 성공한 항체 파이지 디스플레이에 대해서 설명해보려 한다. 이를 설명하기 위해서 항체, 파아지 및 파아지 디스플레이 기술에 대해서 간단히 설명하고 이들의 융합체인 항체 파아지 디스플레이 기술을 알아본다.
1. 항체
항체 신약개발의 핵심기술은 항체 제조기술로 1980년대로 거슬러 올라간다. 마우스란 실험동물에서 항체를 제조할 수 있는 기술이 개발되면서 항체는 암을 극복할 수 있는 '마법의 총알'로 소개되었고 대중으로부터 많은 관심을 끌었지만 인체를 대상으로 한 임상시험에서 실패하였다. 실패 원인은 마우스에서 제작된 항체의 면역원성 때문이다. 인체의 입장에서 보면 마우스 항체는 이물질로 간주되어 체내에 투여될 때 인체의 면역체계는 이를 제거하기 위한 면역작용을 일으키게 되는데 이때 면역을 유발하는 물질의 성질을 면역원성이라 한다. 즉 마우스에서 제작된 항체의 면역원성 때문에 약물개발에 실패하게 된 것이다.
그러나 항체를 이용해서 암을 억제할 수 있는 가능성을 믿은 생명공학자들은 항체의 면역원성을 없애는 연구에 돌입하였으며, 그 결과 마우스항체에 인간항체를 결합시키는 '키메라 항체' 기술이 성공하였다. 미국 FDA는 1997년 레미케이드(류마티스 관절염 치료제)와 리툭산(혈액암 치료제)에 대해 판매를 허가했다. 이로써 항체의약품 시대가 본격적으로 열리게 되었으며, 이후 항체 인간화 기술 및 완전 인간항체 제조기술 개발의 필요성이 대두되었다.
완전 인간항체 제조기술중 대표적인 기술이 바로 파아지 디스플레이를 이용한 인간항체 라이브러리 제조기술이며, 노벨 화학상 수상식에서 언급된 휴미라 항체는 바로 인간항체 라이브러리로 부터 제조된 최초의 항체의약품이기도 하다.
2. 파아지
파아지는 일종의 바이러스이다. 즉 단세포를 감염하는 생명체이다. 단세포중 하나인 박테리아를 감염하는 바이러스를 총칭하여 파아지라고 한다. 파아지는 박테리아를 감염한 상태에서는 생명체이지만 박테리아를 탈출한 상태가 되면 무생물 상태의 입자이다. 즉 나노 크기의 나노입자이다.
파아지가 나노입자란 사실은 매우 중요하다. 부피 1ml(ml은 부피단위로 1리터의 1000분의 1을 지칭함. 한번 칫솔질을 할 때 사용되는 치약의 양정도)에 약 수십조의 파지입자가 농축될 수 있다. 파아지의 증식속도는 상상을 초월한다. 분열이라는 단어 대신 폭발이라는 단어를 사용한다. 즉 30분에 1개가 100개로, 다시 100개가 1만개로 폭발한다. 하루가 지나면 1리터 배양에서 수백조 개의 파지가 생성이 된다. 이러한 파아지의 나노크기와 폭발적 증폭 속도는 향후 1000억종의 항체 라이브러리 제조를 가능하게 한다.
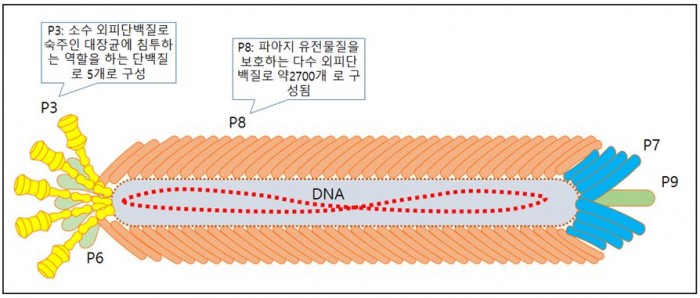
항체 디스플레이에 주로 사용되는 파아지는 M13 파아지다. M13은 박테리아의 필리(pili)를 통해서 감염을 하며 감염후에는 복제가 되어 박테리아를 죽이지 않고 외부로 분비된다. M13의 구조는 아래 그림과 같다. 5개의 외피단백질(P3, P6, P7, P8, P9)로 구성되어 있는데, 여기서 P는 단백질(protein)이란 의미의 이니셜이다. 다수 외피단백질(major coat protein)인 P8은 파지 표면 대부분을 둘러싸고 있으며, P3와 P6는 각각 5개씩 존재하는 소수 외피단백질(minor coat protein)이다. 그 외에 P7, P9 두개의 소수 외피단백질이 존재한다. 이들 5개의 단백질중 항체 디스플레이에 사용되는 단백질은 P3단백질이다. 파지입자는 유전물질인 DNA가 이들 5개의 외피단백질들에 의해서 보호되고 있는 매우 간단한 구조를 하고 있다.
3. 디스플레이 기술
디스플레이 기술은 유전자-단백질의 일대일 연결 기술이다. 유전자-단백질의 연결은 소위 '헤쳐 모여'를 가능하게 하는 기술이다. '헤쳐'는 개별(individual), '모여'는 혼합(mixture)를 나타낸다. 혼합물로 연구하다 필요할 때 개별연구로의 전환이 매우 쉽다. 파아지는 바이러스로 나노크기와 폭발적인 증폭이 가능하며, 이러한 파아지의 특성은 천문학적인 숫자의 단백질연구를 가능하게 한다.
만일 서로 분리된 항체 단백질 백만 개가 있다고 가정하자. 이들을 '모여'하면 그야말로 큰일이 난다. '헤쳐'할수 있는 방법이 없기 때문이다. '모인' 상태의 항체집단에서 특정 기능을 하는 항체 군을 분리한다 해도 이들을 분석할 수 있는 방법이 없기 때문이다. 케미칼 라이브러리도 마찬가지다.
반면에 항체가 파아지 디스플레이가 된 상태는 '모여' 상태(이를 라이브러리라 함)가 되어도 문제가 전혀 없다. 왜냐하면 매우 쉽게 '헤쳐' 상태를 만들 수 있기 때문이다. 항체를 디스플레이한 파아지는 숙주인 대장균을 감염하고 감염된 대장균만 생존할 수 있는 환경을 쉽게 만들 수 있다. 생존한 대장균은 콜로니를 형성하고 이들을 배양하면 각각의 항체를 얻어낼 수 있다. 파아지 디스플레이의 또다른 장점은 나노크기의 입자이다. 바이러스는 숙주 세포내에서는 복제와 증폭을 할 수 있는 생물체이지만 세포 밖에서는 단순한 입자이다. 1mL의 소량의 부피에 약 10조개 이상의 파아지들을 녹일 수 있어서 매우 큰 라이브러리의 제조를 가능하게 한다.
4. 항체 파아지 디스플레이
파아지를 이용해서 항체를 디스플레이 하는 기술을 항체 파아지 디스플레이라고 한다. 항체 파아지 디스플레이 기술은 거대한 항체 라이브러리 제조를 가능하게 한다. 정상인의 혈액 또는 골수에는 제한된 수의 항체 유전자에서 매우 다양한 항체를 생성할 수 있는 mRNA를 만들어 낸다.
이들 항체 mRNA들은 PCR을 통해서 cDNA(complementary DNA)로 역전사될 수 있으며, 증폭된 항체 DNA 절편들을 파아지미드(phagemid)라는 일종의 플라스미드에 클로닝을 할 수 있다. 다양한 항체 DNA를 함유한 파아지미드들을 대장균에 형질전환시킬 수 있으며, 이들의 집합체가 항체 라이브러리가 된다. 즉 항체 라이브러리는 항체 DNA들을 함유한 파아지미드로 형질전환된 대장균 집합체라 볼 수 있다. 항체 DNA들은 정상인으로부터 추출되었기 때문에 항체 라이브러리는 완전 인간항체 라이브러리(fully human antibody library)라 부른다. 형성된 콜로니는 1종류의 항체를 디스플레이한다. 콜로니의 개수가 라이브러리 크기가 된다.

특정항원에 대한 항체를 검색하기 위해선 대장균 집합체인 항체 라이브러리를 배양하면서 적정시기에 M13 헬퍼 파아지(M13 helper phage)를 접종해주면 배양배지로 항체의 파아지미드가 포함되고 항체가 디스플레이된 파아지 입자들을 얻을 수 있으며, 이들을 농축해서 항체 검색에 사용한다.
특정 항체를 선별하는 과정을 알아보자. 생리활성의 모든 기능은 분자간의 결합에 의해서 일어난다. 이러한 생리활성을 억제 또는 활성화를 시키는 항체를 선별하려면 항원에 대한 강한 결합력을 갖는 항체의 선별로 시작된다. 항원-항체의 물리적 결합력을 이용한 대규모라이브러리에서 특정 항원에 결합하는 특정 파아지 집단을 쉽게 분리해 낼 수 있다. 분리된 파아지 집단은 앞에서 언급한 '해쳐' 기술로 쉽게 개별 파아지로 분리할 수가 있으며, 분리된 파아지들은 DNA기술(여기서는 PCR 및 염기서열 분석기술)로 항체의 아이덴티티를 알 수가 있다.
맺음말
항체의약품은 제약회사들의 차세대 성장 동력원이다. 제약산업은 미래 고령화 사회와 맞물려 무병장수하려는 현대인의 욕구로 지속적으로 성장하게 될 것이다. 항체의약품은 제약산업의 중심에 있을 것이고 항체신약을 개발하기 위해서는 인간항체 라이브러리 기술이 필수적이다. 또한 모든 생물학연구에 필수적인 연구용 항체들도 항체 라이브러리에서 검색 제조될 수 있으며, 이러한 기술은 항체 제조를 위해서 사용되는 동물들의 희생을 막을 수 있는 미래의 기술일 것이다.



![[인사]삼양그룹, 정기 임원인사 및 조직개편](https://img.etoday.co.kr/crop/268/200/2248394.jpg)



