기사본문
셀트리온, '램시마 SC' 임상결과 공개.."안전성·유효성 확인"
입력 2018-10-24 11:02 수정 2018-11-13 11:23
바이오스펙테이터 장종원 기자
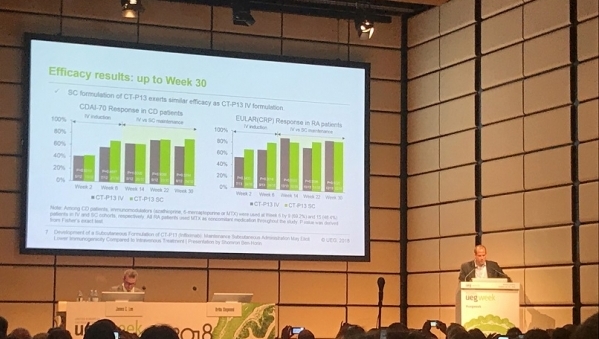
▲23일(현지시간) 오스트리아 빈에서 개최된 UEGW 2018 학회에서 숌론 벤 호린 교수가 램시마 SC 임상결과를 발표하고 있다. 셀트리온 제공.
셀트리온이 자가면역질환 치료용 항체 바이오시밀러 '램시마 SC(Subcutaneous)' 임상 1/3상 Part1 연구 결과를 발표했다. 피하주사제형인 램시마 SC는 기존 램시마와의 비교 임상에서 안전성, 유효성 등이 확인됐다.
셀트리온은 램시마 SC의 임상을 마무리하고 연내 유럽 허가 신청을 위한 준비를 하고 있다.
셀트리온은 23일(현지시간) 오스트리아 빈에서 개최된 유럽장질환학회(UEGW, United European Gastroenterology Week)와 미국 시카고에서 열린 미국류마티스 학회(ACR, American College of Rheumatology)에서 활성 류마티스관절염(Active Rheumatoid Arthritis) 환자와 활성 크론병(Active Crohn’s Disease) 환자 대상 램시마의 피하주사 제형과 정맥주사 제형(IV, Intravenous) 간 약동학, 면역원성, 유효성 및 안전성을 비교한 임상 연구 결과를 발표했다.
셀트리온은 기존 램시마 IV에 이어 TNF-α억제제(자가면역질환 치료제) 시장에서 투트랙 제형 전략을 통한 경쟁력 확보의 일환으로 램시마 SC를 개발해 2016년 5월부터 램시마 SC의 임상을 진행해왔다.
임상에서 연구진은 활성 류마티스 관절염 환자와 활성 크론병 환자를 각각 램시마 IV 투여유지 군, 램시마 SC 투여유지 군으로 나눠 첫 투여 시와 치료 2주차에 모든 환자에게 램시마 IV를 투여했으며, 이후 6주차부터 램시마 IV 투여유지군에는 8주 간격으로 램시마 IV를, 램시마 SC 투여유지군에는 격주로 램시마 SC 약물을 투여하며 총 54주간 각 군별 약동학, 면역원성, 유효성 및 안전성 등을 평가했다.
그 결과, 격주로 램시마 SC를 투여한 군의 체내 약물 농도는 8주 간격으로 램시마 IV를 투여한 군에 비해 안정적으로 유지됐으며 안전성 평가 결과에서 양 군의 데이터는 동등한 수준으로 나타났다.
연구진은 또 유효성 평가를 위해 크론병 활성도 지수(CDAI-70)[3]와 EULAR(CRP) 반응률로 크론병 환자와 류마티스관절염 환자의 질병 개선도를 확인했으며, 데이터 분석 결과 치료 54주차까지 램시마 SC 투여유지군에서 램시마 IV 투여유지군과 유사한 약물 효과가 나타났다고 설명했다.
한편 유럽장질환학회 구술발표(Oral Presentation)에서 램시마 SC 임상 연구 발표의 연자로 나선 이스라엘 텔 아비브 대학(Tel Aviv University) 셰바 메디컬 센터(Sheba Medical Center) 숌론 벤 호린(Shomron Ben-Horin) 교수는 “이번 임상에서 램시마 IV제형과 SC 제형 간 유효성 및 안전성 결과가 유사함을 확인했다”며 “램시마 SC는 세계 의료진과 환자들에게 IV 인플릭시맵의 매력적인 치료 대안으로서의 가능성을 보여주었다”고 말했다.
셀트리온 관계자는 “셀트리온은 램시마 SC의 임상 진행과 병행해 유럽 허가 신청을 준비해 왔으며, 최근 허가 준비 마무리 단계에 돌입했다”며 “추후 램시마 SC가 상업화 되면 세계 의료진들이 환자 상태와 편의를 고려해 단일한 인플릭시맵 성분 약품을 정맥주사 또는 피하주사로 자유롭게 선택해 처방할 수 있을 것으로 기대된다”고 말했다.







