기사본문
셀트리온, 美 FDA서 허셉틴 바이오시밀러 판매허가
입력 2018-12-15 07:39 수정 2018-12-15 08:00
바이오스펙테이터 장종원 기자
셀트리온이 개발한 허셉틴 바이오시밀러 허쥬마(HERZUMA)가 미국 시장의 문을 넘었다. 셀트리온은 이번 승인으로 개발 완료한 바이오시밀러 3종 모두가 미국, 유럽에서 허가 받았다.
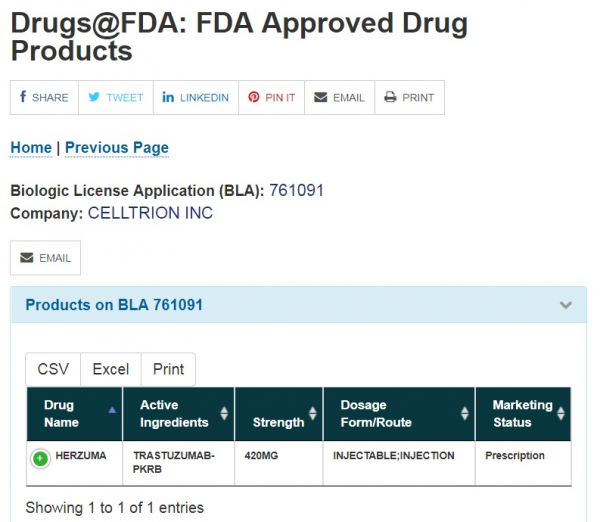
미국 식품의약국(FDA)은 14일(현지시간) 셀트리온이 제출한 허쥬마의 판매승인신청서(Biologic License Application, BLA)를 승인했다고 밝혔다.
허쥬마는 유방암, 위암 등의 치료에 쓰이는 항암 항체 바이오시밀러로 오리지널의약품은 제넨텍(Genentech)이 개발하고 로슈(Roche)가 판매하는 ‘허셉틴’이다. 전세계 8조원 규모(미국은 3조원)의 시장을 형성하고 있다.
셀트리온은 2017년 7월 허쥬마의 미국 판매허가를 FDA에 신청했으며 한차례 서류 보완(Complete Response Letter)을 거쳐 이번에 판매허가를 얻었다. 셀트리온은 앞선 지난 2월 허쥬마 유럽 판매허가를 받았으며 5월 영국을 시작으로 제품 판매에 들어갔다.
이번 허쥬마의 미국 승인은 작년 12월 앞서 허가받은 '오기브리(밀란/바이오콘)'에 이어 허셉틴 바이오시밀러로는 두번째다. 다만 허셉틴의 미국 특허가 남아 있어(2019년 6월 만료 예정) 아직 출시되지는 않았다. 삼성바이오에피스(2017년 12월), 암젠/앨러간(2017년 7월), 화이자(2017년 7월) 등도 허셉틴 바이오시밀러 허가를 신청해 미국 FDA 심사를 받고 있다.
셀트리온의 허쥬마는 미국 특허가 만료되는대로 다국적 제약사 테바(TEVA)를 통해 판매될 예정이다. 테바는 지난달 29일 FDA 허가를 받은 셀트리온의 리툭산 바이오시밀러 트룩시마와 허쥬마의 북미 판권을 보유하고 있다.
기우성 셀트리온 대표는 "미국 유방암 환자들의 삶의 질 제고에 기여하게 돼 무척 기쁘게 생각한다”며 “유럽 등에서 많은 처방 데이터로 입증된 셀트리온 바이오시밀러에 대한 신뢰를 미국 시장에서도 확인할 수 있기를 고대하고 있다”고 말했다.
한편 이번 승인으로 셀트리온은 램시마, 트룩시마, 허쥬마 3종을 미국, 유럽 등 메이저 시장에 모두 내놓게 됐다. 셀트리온은 주요 전략 제품 3종 허가를 통해 전 세계 바이오의약품 매출의 50% 이상을 차지하는 최대 시장 미국에서 바이오시밀러 제품의 본격적인 판매 확대가 이뤄질 수 있을 것으로 기대하고 있다.
셀트리온은 2016년 4월 미국에서 최초의 항체 바이오시밀러 램시마를 허가 받아 다국적 제약사 화이자(Pfizer)를 통해 ‘인플렉트라(INFLECTRA)’라는 판매명으로 판매하고 있다. 인플렉트라는 지난 3분기 미국에서 7100만달러의 매출을 기록했으며 올해 2억5000만달러 매출 돌파가 기대된다.