기사본문
엘베이스 "CAGE, 자기포식 조절..항암 내성 신타깃"
입력 2019-03-08 06:36 수정 2019-03-08 06:36
바이오스펙테이터 조정민 기자

국내 신약개발기업 엘베이스가 암과 정소에서 발현하는 신항원 'CAGE(Cancer Associated GEne)'가 자가포식을 조절함으로써 항암제 내성에 관여한다는 연구결과를 내놨다. CAGE가 암 특이적 자가포식 조절 타깃이 될 수 있음을 확인한 것이다. 엘베이스는 CAGE를 타깃해 화학항암제, 표적항암제에서 보이는 내성문제를 동시에 극복하는 신규 기전의 펩타이드 항암신약을 개발하고 있다.
엘베이스는 최근 '프론티어 인 온콜로지'에 발표한 논문을 통해 CAGE가 자가포식을 억제하는 기전을 밝힘과 동시에 개발 중인 펩타이드 후보물질이 자가포식을 효과적으로 억제함으로써 EGFR 변이가 발생한 비소세포폐암(Non-small cell lung cancer) 세포에서 종양의 성장을 억제하고 항암제의 치료 효능을 증대시키는 연구결과를 소개했다.
◇자가포식 억제하면 항암효과↑..암 내성과 밀접한 관련
자가포식은 기능이 상실된 미토콘드리아 등 세포 소기관과 변성 단백질, 축적된 지방을 분해해 세포 내부 항상성과 세포 생리 기능을 유지하는 과정을 말한다. 일본 도쿄공업대 오스미 요시노리(大隅良典) 교수가 2016년 자기포식 현상의 분자수준 기전을 발견해 노벨 의학·생리학상을 수상하는 등 다양한 연구가 확산하고 있다.
자가포식은 크게 개시(Initiation), 소체 핵 형성(Vesicle nucleation), 소체 확장(Vesicle elongation), 소체 융합(Vesicle fusion), 분해(Degradation) 5가지 단계를 거쳐 이뤄진다. 이러한 자가포식이 정상적으로 조절되지 않으면 퇴행성 신경질환 및 암 등 여러 질병이 발병하는 것으로 알려져 있다.
항암 관련해서는 자가포식을 억제하면 항암제의 치료효과가 높아진다는 연구결과들이 다수 나오고 있다. 전도용 엘베이스 대표는 특히 "암의 내성 발현과 관련해 오토파지(자기포식)의 중요성이 일반적으로 받아들여지고 있다"고 설명했다.
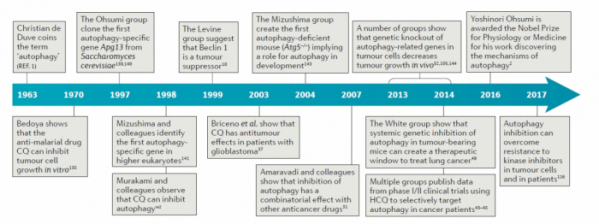
▲자가포식과 암 관련 연구결과 타임라인 (출처: Targeting autophagy in cancer/Nature/2017)
2017년 국제 학술지 네이처(Nature)에 게재된 리뷰 논문을 살펴보면, 항암제와 자가포식 억제제의 병용을 통해 항암 효과를 높이기 위한 임상 연구들이 다양한 암 종을 대상으로 진행되고 있다. 이 논문에서는 암세포의 상태에 따라서 자가포식의 기능이나 역할이 달라지기 때문에 항암 효과 역시 증가하거나 감소하는 등 정반대의 작용을 할 수 있어 암 특이적인 자가포식 조절 메커니즘을 파악해 적절한 타깃에 적용하는 것이 중요하다고 강조했다.
하지만 암 특이적으로 자가포식 기능을 조절할 수 있는 타깃이 아직까지 명확하게 밝혀지지 않아 거의 모든 임상들이 자가포식 억제제로 오래된 약물인 클로로퀸 또는 하이드록시클로로퀸을 사용하고 있는 실정이다. 클로로퀸이나 하이드록시클로로퀸은 자가포식소체가 SNARE 단백질 STX17에 의해 리소좀(Lysosome)과 결합하면서 만들어지는 자기포식 용해소체(Autophagolysosome) 형성을 방해함으로써 자가포식을 억제하는 기전을 가진다.
◇CAGE 자가포식 조절 기전 확인.."암 특이적 자가포식 억제해 항암제 내성 극복 가능성”

엘베이스는 이번 논문에서 CAGE가 자가포식을 조절함으로써 항암제 내성에 관여한다는 것을 밝혔다. CAGE는 주로 암과 정소에서 발견되는 CTA 항원으로 암의 지속적인 성장, 혈관 신생 유도, 세포사멸 회피, 다른 조직으로의 침윤 및 전이과정 등에 다양한 역할을 하는 것으로 알려졌다. 구체적으로, CAGE는 CyclinD1과 비활성화 GSK3β를 증가시킴으로써 암의 발병 및 약물 저항성을 촉진시킨다.
연구진은 EGFR 유전자의 ex 19 del과 T790M 변이가 발생한 타세바 내성 비소세포폐암 세포주 PC-9/ER 세포의 경우 변이가 발생하지 않은 PC-9 세포에 비해 자가포식 발생이 더 높다는 것을 여러가지 지표를 통해 확인했다. 이러한 결과는 자가포식 발생의 조절이 항암제 내성과 아주 밀접한 관련이 있음을 보여준다.
이들은 타세바(성분명 Erlotinib), 타그리소(성분명 Osimertinib)가 자가포식을 증가시키는 것을 관찰했다. 또한 이들은 PC-9/ER세포에 타세바 또는 타그리소와 자가포식을 억제하는 클로로퀸을 병용한 결과에서 약물 반응성이 강화되는 것을 확인했다. 이 때, 클로로퀸은 CAGE와 Beclin1의 결합을 억제했으며 용량의존적으로 PC-9/ER세포에서의 CAGE 발현을 낮췄다. 자가포식의 중요 인자인 Beclin1과 CAGE의 결합은 CAGE가 자가포식을 조절하는데 역할을 한다는 추측을 가능하게 한다.
연구진은 PC-9/ER세포에서는 CAGE가 Beclin-1과 EGFR, HER2와 결합하지만 PC-9세포에서는 결합하지 않는다는 것을 실험을 통해 확인했으며, 타세바와 타그리소를 PC-9세포에 적용하면 CAGE와 Beclin-1의 결합이 유도되는 것을 관찰했다. 이러한 결과는 CAGE와 Beclin-1의 결합이 항암제 내성과 관련이 있음을 보여준다.
이들은 CAGE에 관여하는 펩타이드 266-AQTGTGKT-273을 PC-9/ER 세포에 적용했을 때, CAGE와 Beclin-1의 결합이 억제되는 결과를 얻었다. 연구진은 해당 펩타이드가 CAGE와 Beclin-1의 결합 억제를 통해 자가포식 작용을 조절한다고 밝혔으며 타그리소, 타세바와 함께 병용했을 때 항암제 내성 비소세포 폐암 치료를 유의미하게 개선할 것으로 예측했다.
실제로 PC-9/ER 세포주에 266-AQTGTGKT-273 펩타이드를 형질주입하고 타그리소, 타세바를 적용한 결과 대조군과 비교해 세포 성장이 유의미하게 억제되는 것을 확인했으며 세포의 이동(migration)이나 침투(invasion) 역시 각각 70%, 40% 감소하는 것을 관찰했다. 펩타이드가 형질주입된 PC-9/ER세포에 타그리소, 타세바를 적용하면 세포사멸의 지표로 사용되는 C-PARP 단백질의 농도가 높아지는 것도 확인했다. 항암제에 대한 반응율을 높임으로써 암세포 사멸이 증가하는 것이다.
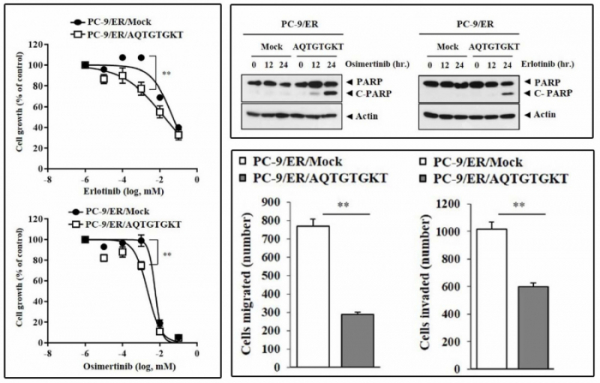
▲출처: CAGE binds to Beclin1, regulates autophagic flux and CAGE-derived peptide confers sensitivity to anti-cancer drugs in non-small cell lung cancer cells/Frontier in Oncology/2018
세포에서 효과를 확인한 연구진은 동물실험을 진행했다. 누드 마우스에 PC-9/ER세포를 이식하고 50 세제곱 미리미터(mm3) 크기의 종양이 형성된 이후 펩타이드를 각각 50, 100, 200μg 농도로 꼬리 혈관을 통해 주입했다. 그 결과 농도 의존적으로 종양성장이 억제되는 것이 관찰됐다. 또한 동물에서 채취한 종양을 분자생물학적으로 분석한 결과, 펩타이드를 적용해 크기가 줄어든 종양의 경우 자가포식 관련 바이오 마커들이 현저하게 감소된 것을 알 수 있었다.

▲출처: CAGE binds to Beclin1, regulates autophagic flux and CAGE-derived peptide confers sensitivity to anti-cancer drugs in non-small cell lung cancer cells/Frontier in Oncology/2018
해당 연구를 통해 엘베이스는 CAGE가 자가포식을 조절하며 이를 통해 항암제 내성 폐암에서 항암제 반응성을 강화, 종양조직을 줄어들게 하는 기전을 처음으로 입증했다.
전도용 엘베이스 대표는 “지금까지 자가포식이 폐암 등의 암 종의 내성에서 중요하다는 것을 알려져 왔지만 정확한 기전에 대해 알지 못해 항암제 내성 극복에 어려움을 겪어왔다. 이번 연구를 통해 CAGE를 타깃해 내성이 유발된 암에서 활성화되는 자가포식작용을 특이적으로 조절할 수 있다는 것을 보여줬다. 따라서 비소세포폐암 뿐만 아니라 자가포식이 문제가 되는 여러 암종으로의 적응증 확대도 가능할 것으로 기대된다”고 말했다.







