기사본문
이수앱지스, 'ErbB3 표적' 항체신약 1상Part1 결과는
입력 2019-09-30 21:45 수정 2019-09-30 21:49
바이오스펙테이터 바르셀로나(스페인)=장종원 기자
▲전재현 이수앱지스 개발본부장
이수앱지스가 ErbB3 표적 신약후보물질 'ISU104'의 임상 1상 Part1에서 안전성과 유효성을 확인하고 Part2 임상에 속도를 낼 동력과 개발전략을 확보했다. 특히 15명의 전이성 고형암 환자를 대상의 임상에서 질병통제율(DCR)은 60%였으며 특히 두경부암에서는 85.7%의 결과를 얻었다.
이수앱지스는 28일(현지시간) 스페인 바르셀로나에서 열린 유럽종양학회(ESMO 2019)에서 포스터 디스커션 세션(Poster Discussion Session)을 통해 이같은 1상 Part1 결과를 최초로 공개했다.
ISU104는 암의 발생에 관련한 체내의 ErbB 단백질 그룹 중 세 번째인 ErbB3를 제어하는 표적 항체치료제다. ErbB1과 ErbB2는 이미 얼비툭스(Erbitux, 세툭시맙)와 허셉틴(Herceptin, 트라스투주맙)이라는 블록버스터 제품이 출시돼 있으며, ErbB3를 제어하는 치료제는 아직 없다. ErbB3는 표준 항암 치료법에 대한 약물 내성의 주요 원인 중 하나로 알려져 있어 기존 항암제에 내성이 생긴 난치암 치료에 효과를 기대하고 있다.
이수앱지스의 임상 1상 Part 1은 'ISU104'의 투약 용량을 1mg/kg부터 20mg/kg까지 증량해 안전성을 확인 후 최대 내약 용량을 결정하는 '용량증량 코호트' 연구로 진행했다. 임상 참여자는 표준치료법에 실패한 전이성 고형암 환자 15명으로 두경부암(7명), 대장암(4명), 식도암(2명), 유방암(1명), 비소세포폐암(1명) 순이었다.
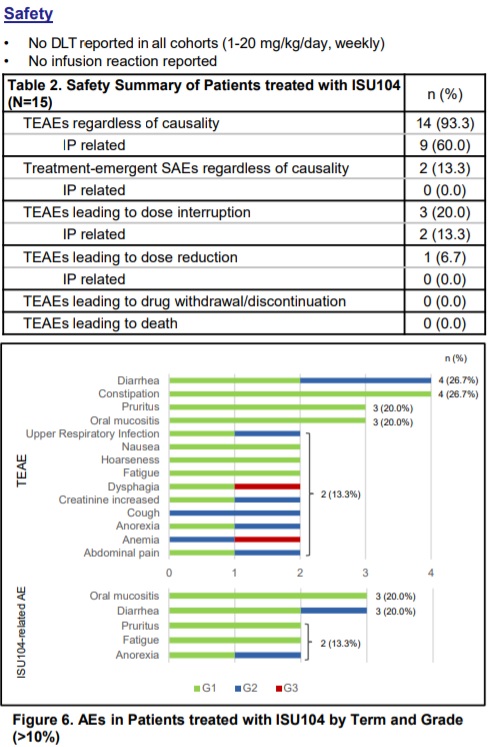
먼저 안전성 측면에서는 용량증량에 따른 용량제한독성(DLT)이 확인되지 않았다. 또한 ISU104와 관련된 부작용은 총 8건으로 구강점막염(Oral mucositis)이 3건, 설사(Diarrhea)가 3건(1건은 Grade2), 식욕부진(Anorexia)이 2건(1건은 Grade2), 피로(Fatigue)가 2건 등이었다.
전재현 이수앱지스 개발본부장 "ISU104와 관련한 부작용은 모두 Grade1, Grade2로 기존에 알려준 수준이었다"면서 "특히 표준치료법의 대표적 부작용인 Diarrhea가 적은 것은 ISU104의 병용요법 치료제 가능성을 보여준다"고 설명했다.
유효성 측면에서는 60%(9/15명)의 질병통제율(DCR, ITT군)을 확인했다. 53.3%(8명)가 안정병변(Stable Diesase, SD), 6.7%(1명)는 부분반응(Partial response, PR)을 보였다. 특히 두경부암 환자로 범위를 좁히면 DCR은 85.7%(5/6명)으로 나타났고 이 중 SD가 71.4%(4명), PR이 14.3%(1명)였다. 전 본부장은 "단독요법으로 60% 이상의 질병통제율, 특히 두경부암의 80%대의 DCR은 의미있는 결과"라고 생각한다"면서 "병용요법을 통해 DCR, PR을 더 높일 수 있을 것으로 기대한다"고 말했다.

이수앱지스는 이러한 결과를 바탕으로 1b상 개념의 Par2 임상에 돌입한다. Part2는 약 40여명의 환자를 대상으로 진행될 예정으로 임상 2상 권장용량(RP2D, Recommended Phase 2 Dose)을 반복 투여해 유효성을 확인하는 연구로 진행할 계획이다.
Part2 환자군은 Part1의 결과에 따라 두경부암, 대장암, 유방암으로 좁혔으며 3주간격으로 ISU104를 20mg/kg 용량으로 투여하는 임상이 진행된다. 다만 임상 진행 과정에서 ISU104를 1주간격으로 투여하는 방안도 검토가능하다는 설명이다.
특히 ISU104 Part2는 단독요법과 병용요법(세툭시맙)으로 연구가 진행된다. 전 본부장은 "세툭시맙과의 병용을 통해 빠른 효과와 포텐셜을 보여주려고 한다"면서 "세툭시맙 단독 투여의 낮은 효과를 ISU104가 보완해준다면 언맷니즈를 충족시킬 수 있다"고 설명했다. 이수앱지스는 바이오마커 연구를 통해 임상의 성공 가능성을 높이는 전략도 갖고 있다.
전 본부장은 "경쟁사인 셀덱스가 두경부암 표적 ErbB3 2상을 진행하고 있지만 우리 긍정적인 데이터의 안전성과 유효성을 바탕으로 임상에 속도를 높이면 1년차 정도는 충분히 경쟁해 볼만하다"면서 "Part2 연구는 내달 첫 투약이 시작될 계획"이라고 강조했다.







