기사본문
지투지, AAIC서 치매 '1개월 도네페질' "전임상 발표"
입력 2021-07-27 10:46 수정 2021-07-27 11:27
바이오스펙테이터 김성민 기자

지투지바이오(G2GBIO)가 임상1상을 앞두고 있는 1개월 약효지속성 도네페질(donepezil) 약물의 비임상 결과를 글로벌 학회에서 공개한다. 도네페질은 아세틸콜린분해효소 저해제(acetylcholinesterase inhibitor)로 알츠하이머병 환자가 1일 1회 경구 복용하는 약물이다.
지투지바이오는 도네페질 개량신약으로 1개월에 한번 근육주사(IM)하는 ‘GB-5001’을 개발하고 있으며, 26일부터 30일까지(현지시간) 열리는 ‘알츠하이머병협회 국제컨퍼런스(AAIC) 2021’에서 비임상 결과를 발표할 예정이라고 27일 밝혔다.
지투지바이오는 기존의 경구용 약물은 약을 삼키기가 곤란하거나 위장장애 등 부작용 또는 적절한 약물용량을 체내에서 유지하기 어려움 등 다양한 이유로 치매 환자에게는 약을 복용하는게 쉽지 않다는 점에 주목했다.
지투지바이오의 GB-5001은 한 달에 한 번만 투여하면서 기존의 약물과 유사하게 환자의 혈액내에서 장기간 약효농도를 유지할 수 있어, 기존 치매 치료제가 갖는 낮은 복약순응도, 위장장애 및 피부 부작용 등 여러 문제들을 개선할 수 있다고 회사측은 설명했다.
GB-5001은 지투지바이오의 이노램프(InnoLAMP®) 기술이 적용된 것이다. 약효물질을 생분해성 고분자와 섞어 균일한 크기의 미립구(microsphere)를 제조하는 방식이며, 성분비율에 따라 약효가 녹아나오는 속도를 조절할 수 있다. GB-5001은 도네페질과 PLGA 기질(matrix)를 섞어 제작했다. 지투지바이오는 이노램프 기술로 일정한 크기의 미립구를 제작해 약물이 방출되는 속도를 정밀하게 조절할 수 있으며, 기존 기술과 비교해 스케일업(scale-up) 측면에서 장점을 가진다는 점을 강조한다.
이번 AAIC에서 공개하는 데이터는 비임상 모델에서 3개월 독성 연구가 주된 내용이다.
지투지바이오는 각각 수컷·암컷 비글견(Beagle dog) 16마리에 4주마다 3가지 용량의 GB-5001(280, 560, 1120mg/dose) 또는 대조약(vehicle) 근육주사해(Intramuscular Injection, IM) 다양한 지표에 걸쳐 독성과 약동학적(PK) 특성 등을 평가했다.
전임상 결과 모든 투약 용량에서 약물 내약성을 확인했으며, 독성학적으로 유의한 임상 변화나 병리학적 발견이 없었다. 또한 약물 혈중농도가 모든 그룹에서 일정하게 유지되는 것을 확인했다.
한편 지투지바이오는 GB-5001의 비임상시험을 모두 완료했으며, 현재 캐나다에서 임상시험을 진행하기 위한 임상시험계획서(IND) 제출을 준비하고 있다고 밝혔다.
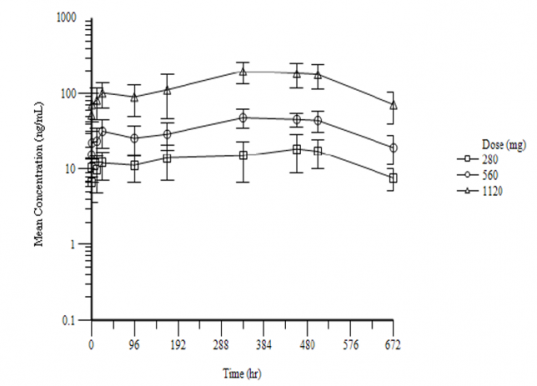
▲GB-5001의 3회 투여 후 28일간 도네페질 혈중농도, 회사제공







