기사본문
아델릭스, CKD 고인산혈증 '테나파노' FDA "승인거절"
입력 2021-08-04 10:32 수정 2021-08-04 13:12
바이오스펙테이터 윤소영 기자
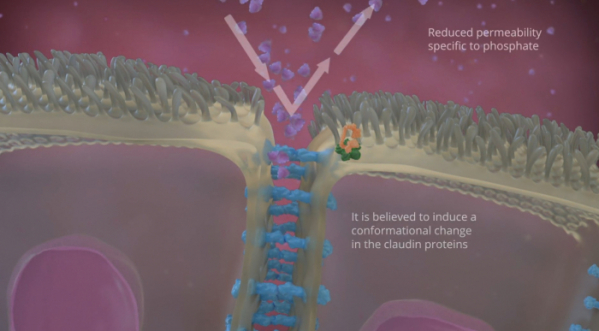
▲‘테나파노(Tenapanor)’ 작용기전(아델릭스 홈페이지)
아델릭스(Ardelyx)의 고인산혈증(hyperphosphatemia) 조절 약물인 ‘테나파노(Tenapanor)’가 긍정적인 임상3상 결과에도 불구하고 미국 식품의약국(FDA)의 신약승인이 거절됐다. 임상적 의미가 불분명하다는 이유에서다. 며칠 전 FDA는 아델릭스에 테나파노의 임상적 연관성(clinical relevance)과 관련한 지적을 했으며 이는 결국 승인 거절로 이어지게 됐다.
이 소식에 아델릭스의 주가는 80% 가까이 떨어지기도 했다.
아델릭스는 지난달 29일(현지시간) FDA가 테나파노의 신약승인신청서(NDA)에 대해 최종보완요구서(CRL)를 발행했다고 발표했다. 테나파노는 투석이 필요한 만성 신부전(chronic kidney disease, CKD) 환자의 혈중 인(serum phosphorus)을 조절하는 치료제로 개발중인 약물이다.
발표에 따르면 FDA는 CRL에서 “테나파노는 투석이 필요한 CKD 환자의 혈중 인 농도를 낮추는 효과는 확실히 있지만 임상적 의미가 불분명하다”며 “테나파노가 이 적응증으로 승인받기 위해서는 혈중 인을 낮추는 효과에 대한 임상적 의미와 투석 CKD 환자의 고인산혈증(hyperphosphatemia)에 대한 임상적 효과를 보여줘야한다”고 지적했다. 안전성, 약리/약제, 생산(CMC) 등의 문제는 없었다.... <계속>







