기사본문
Syndax HDAC1 저해제+키트루다 "폐암서 실망스런 결과"
입력 2018-05-21 10:28 수정 2018-05-21 10:28
바이오스펙테이터 김성민 기자
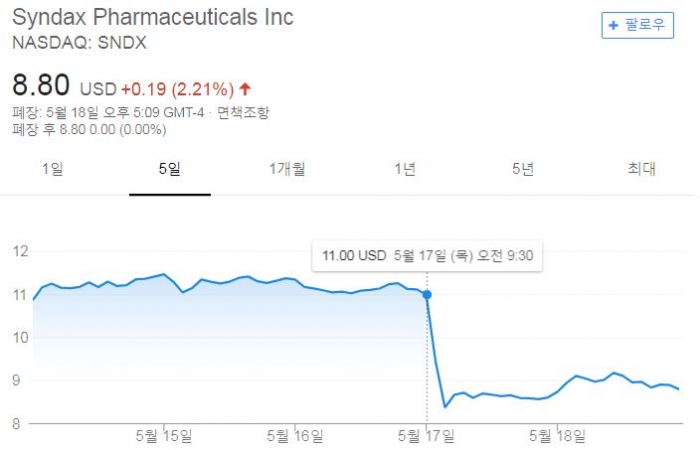
미국임상종양학회(ASCO, American Society of Clinical Oncology)를 앞두고 초록정보가 공개되면서 신닥스파마슈티컬(Syndax Pharmaceuticals)이 충격에 휩싸였다. 비소세포폐암(NSCLC) 환자를 대상으로 한 신닥스의 HDAC1 저해제인 '엔티노스태트(entinostat)'와 키트루다를 병용투여한 ENCORE 601 임상1b/2상에 대한 실망스런 결과를 발표하면서다(NCT02437136). 지난 17일 신닥스의 주가는 23% 하락했다.
초록에 따르면, 기존 약을 투약받은 환자에 엔티노스태트+키트루다를 병용투여했을 때 객관적반응률(ORR)은 11%, 병기진행이 멈춘 무진행생존기간(PFS)은 2.5개월에 불과했다. 약물반응 기간의 중간값은 4.6개월이었다. 1년전 신닥스가 발표했던 31%의 반응률에 비해서 감소한 수치다.
약물부작용으로는 35.1%(n=20)의 환자가 3/4등급 부작용을 보였으며, 6명에서는 폐렴 등 면역과 관련된 부작용(irAEs)이 나타났다. 가장 흔한 부작용(>15%)으로는 피로감, 빈혈, 식욕감퇴, 설사부작용이 나타났다.
신닥스는 바이오마커로 혈액내의 '높은 단핵구 수치(monocyte level)'를 가지는 환자(14/57)에서 PFS는 5.4개월, ORR은 29%로 항암효능이 더 우수하다고 주장하고 있다. 반대로 단핵구 수치가 낮은 환자에서 ORR은 5%, PFS는 2.5개월로 관찰됐다. 신닥스는 규제당국이 동의한다면 단핵구 수치를 환자모집에 반영하겠다는 입장을 밝혔다.
Wistar Institute의 Dmitry Gabrilovich 연구원은 "단핵구 수치는 면역억제가 제거된후 면역 시스템의 능력을 반영할 수도 있다"며 "신닥스의 데이터는 PD-1 혹은 전처리(pre-treated)를 받은 그룹에서 엔티노스태트+키트루다 병용투여 임상결과와 단핵구 수치와 연관성을 보여주며, 향후 임상에서 환자선별에 사용될 수 있는 잠재력을 보여준다"고 설명했다.
신닥스는 미국 식품의약국(FDA)과 유럽 식품의약청(EMA)과 미팅을 가져 미팅을 가져 프로토콜 디자인에 대해서 논의할 계획이다. 임상결과는 2020년 도출될 예정이다.
머크 외에도 신닥스는 다양한 암종에서 병용투여 파트너십을 구축하고 있다. 삼중음성유방암(TNBC) 환자에서 엔티노스태트과 제넨텍의 테센트릭(atezolizumab, PD-L1 항체)를 병용투여하는 ENCORE 602 임상1/2상을 진행하고 있다(NCT02708680). 또한 진행성 상피성난소암(epithelial ovarian cancer)에서는 머크-화이자의 바벤시오(avelumab, PD-L1 항체)와 병용투여하는 ENCORE 603 임상1/2상을 진행하고 있다(NCT02915523).
신닥스는 종양미세환경에서 면역억제세포인 TAM(Tumor Associated Macrophages)의 세포표면에 발현하는 CSF1R 타깃 항체인 ‘SNDX-6352'로 임상1상을 진행하고 있다. 올해초 신닥스는 SNDX-6352와 아스트라제네카의 임핀지(durvalumab, PD-L1 항체)를 병용투여하는 파트너십을 체결한 바 있다.
한편 국내에서는 크리스탈지노믹스가 후성유전학 인자인 HDAC을 전반적으로 저해하는 pan-HDAC 저해제인 'CG200745'를 개발하고 있다. CG200745는 HDAC1을 특이적으로 억제하는 엔티노스태트 보다 범용적인 저해제다. CG200745는 췌장암, 골수형성이상증후군(MDS)을 대상으로 임상2상을 진행하고 있다.
크리스탈은 국내외 면역항암제 기업와 병용투여 파트너십을 구축하고 있다. 와이바이오로직스의 PD-1 혹은 PD-L1 항체와 병용투여에 따른 시너지효과를 연구하고 있다. 이어서 지난달 크리스탈지노믹스는 미국 씨비티파마슈티컬스(CBT Pharmaceuticals, CBT파마)의 PD-1 항체인 'CBT-501'와의 병용투여 임상을 진행키로 협약했다. CBT-501은 현재 고형암 환자를 대상으로 임상1상을 진행하는 파이프라인이다.
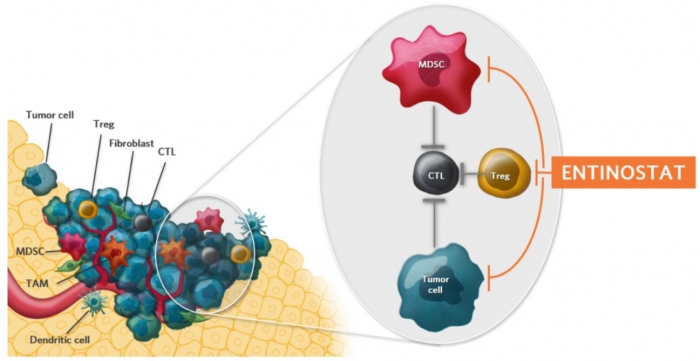
▲종양미세환경내 HDAC1 저해제인 'Entinostat' 작용기전, Syndax 홈페이지 참조







