기사본문
지엘팜텍 '프레가발린 개량신약' 시장 열었다
입력 2019-01-14 07:03 수정 2019-01-14 07:05
바이오스펙테이터 장종원 기자

지엘팜텍이 블록버스터 신경병증성 통증치료제 리리카(성분명 프레가발린)의 개량신약 개발과 품목허가 획득에 성공했다. 2012년 7월 임상 1상 승인 이후 약 8년만에 독자기술로 제품개발을 완료한 것이다. 특히 지엘팜텍이 개발과정에서의 기술이전한 국내 다수 제약사가 이번에 동시 품목허가를 받아 프레가발린 개량신약 시장 활성화와 이에 따른 경상기술료 수입을 기대할 수 있게 됐다.
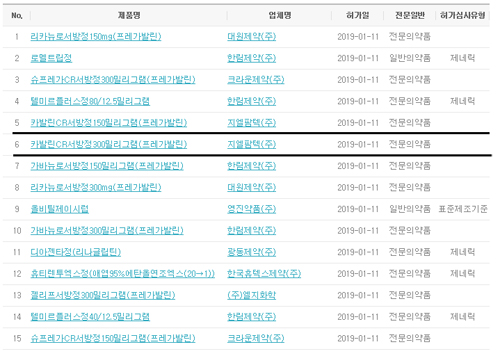
14일 업계에 따르면 식품의약품안전처는 지난 11일 지엘팜텍의 신경병증성 통증치료제 개량신약 '카발린CR서방정150mg/300mg(프로젝트명 : GLA5PR)' 시판을 허가했다. 작년 7월말 품목허가 신청을 받은 후 약 6개월만에 승인 결정을 내렸다.
GLA5PR은 화이자의 신경병증성 통증치료제 프레가발린의 개량신약이다. 지엘팜텍은 독자적인 GLARS 서방형 제제기술을 통해 1일 1회(프레가발린은 1일 2회) 복용 가능토록 했다. 평생 복용해야 하는 프레가발린의 복용 편의성 개선은 중요한 과제였다.
개량신약 개발 전문기업 지엘팜텍은 2012년 7월 임상 1상 승인을 받고 GLA5PR 개발에 돌입했다. 2015년 12월 임상 3상을 승인받았으며 2018년 3월 임상 3상 시험 투약을 완료했다.
GLA5PR은 임상 3상 일차 유효성 평가에서 종료시점(12주)의 평균 통증 점수가 시험군은 대조군과 비교해 비열등함을 확인했다. 안전성에 있어서도 임상시험용의약품과의 인과관계와 상관없이 발현된 모든 이상반응(TEAE) 발현율은 시험군, 대조군간 통계적으로 유의한 차이를 나타내지 않았다.
화이자의 프레가발린은 국내 500억원, 전세계로는 50억 달러(5조 6000억원) 규모의 매출을 일으키는 블록버스터 제품이다. 2017년 용도 특허가 만료되면서 제네릭 의약품이 쏟아져 나오는 등 경쟁이 치열하다. 지엘팜텍은 작년 12월말 독점판매계약(독점도입료 10억원)을 맺은 CJ헬스케어를 통해 국내 신경병증성 통증시장에 뛰어들 계획이다.
특히 식약처는 같은날 LG화학(젤리프서방정150/300mg), 대원제약(리카뉴로서방정150/300mg), 한림제약(가바뉴로서방정150/300mg), 지엘팜텍 자회사 크라운제약(슈프레가CR서방정150mg/300mg, 일동제약이 독점판매) 등도 품목허가 했다. 모두 지엘팜텍의 기술이전을 받은 프레가발린 서방형 제품이다. 국내 제약사 다수가 프레가발린 서방형 시장에 진출함에 따라 시장 활성화와 함께 지엘팜텍은 경상기술료 수입도 기대할 수 있게 됐다.
지엘팜텍은 미국 식품의약국(FDA) 임상 승인을 받아 글로벌 시장 진출도 추진하고 있다.