기사본문
캐리오팜, ‘엑스포비오’ RRMM 치료제 FDA 승인
입력 2019-07-05 16:28 수정 2019-07-05 16:28
바이오스펙테이터 이승환 기자

미국 식품의약국(FDA)은 미국 캐리오팜(Karyopharm)이 개발한 경구형 핵외수송 선택적 억제제(selective inhibitor of nuclear export, SINE) ‘엑스포비오(Xpovio, 성분명 selinexor)’를 재발성, 불응성 다발성 골수종(relapsed refractory multiple myeloma, RRMM) 치료제로 지난 3일 가속 승인(accelerated approval)했다. 이번 승인으로 엑스포비오는 핵외수송 단백질인 XPO1(exportin 1)을 억제하는 first-in-class 경구형 치료제가 됐다.
항염증제 덱사메타손(dexamethasone)과 병용하는 엑스포비오는 프로테아좀 억제제(proteasome inhibitor, PI), 면역조절 이미드 치료제(Immunomodulatory imide drugs, IMiD), CD38 항체를 투여받았음에도 치료에 실패한 재발성 다발성 골수종 환자를 대상으로 사용할 수 있도록 승인받았다. 3가지 계열의 치료제를 사용하고도 치료에 실패한 경우에는 삼중불응 다발성 골수종(triple class refractory multiple myeloma)으로 분류하기도 한다. 엑스포비오, 덱사메타손 병용요법은 삼중불응 다발성 골수종을 앓고 있는 18세 이상 성인 환자에게 엑스포비오 80mg, 덱사메타손 20mg을 일주일에 2번 투여한다.
엑스포비오의 FDA 승인 발표 직후, 캐리오팜의 주가는 36% 이상 치솟았다. 캐리오팜은 이번 달 10일 이전에 미국에서 엑스포비오 판매를 시작할 계획이며, 유럽판매를 위해 유럽 의약품기구(European Medicines Agency, EMA)의 임상시험 검토 결과를 기다리고 있다.
미국 국립암연구소(National Cancer Institute, NCI)에 따르면 다발성 골수종은 미국에서 2번째로 많은 환자 수를 보이는 혈액암이다. 미국에서 매년 3만2000명이 다발성 골수종으로 진단받으며, 13만명이 넘는 환자가 있는 것으로 집계됐다. NCI는 2019년에만 다발성 골수종으로 1만3000명이 사망할 것으로 예상한다. 다발성 골수종은 정확한 원인이 밝혀지지 않아 완치할 수 있는 치료제가 개발되지 않았다.
암세포는 정상 세포보다 높은 수준의 단백질 발현량을 보인다. 암세포가 다량 발현하는 단백질에는 성장과 증식에 관여하는 단백질이 있으며, 종양 억제 단백질(tumor suppressor proteins)은 발현량이 적은 것으로 알려졌다. XPO1 단백질은 세포의 핵 안에서 합성된 단백질, rRNA(robosomal RNA), snRNA(small nuclear RNA), mRNA(messenger RNA)를 세포질(cytosol)로 이동시키는 기능을 하는데, 암세포에서 XPO1 단백질이 정상 세포보다 높게 발현되는 것이 발견됐다.
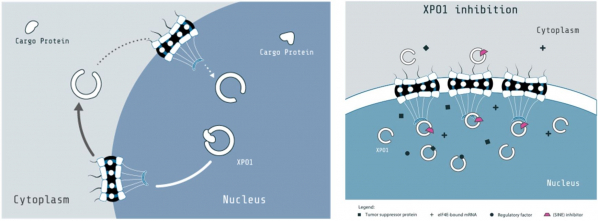
▲XPO1 단백질 기능 및 엑스포비오 기전(캐리오팜 홈페이지 제공)
암세포는 DNA 전사(transcription)에 관여하는 단백질 발현량이 높아 RNA 생성량이 정상 세포보다 많다. XPO1이 RNA를 세포질로 옮기면, 단백질 합성과정인 번역(translation)이 촉진된다. 캐리오팜은 핵 외부로 물질을 옮기는 XPO1을 억제해 암세포의 병리 단백질 발현을 막는 항암제 엑스포비오를 개발했다. 암세포의 성장과 증식에 관여하는 단백질 발현을 막아 항암효과를 내는 컨셉이다. 전임상시험에서 XPO1 억제제는 종양 억제 단백질을 발현하지 않는 암세포의 성장과 증식을 막고 세포사멸을 유도했다고 캐리오팜은 발표했다. 그리고 정상 세포에서는 XPO1 억제제 투여로 세포사멸이 나타나지 않았으며, XPO1 억제제 투여 중단 시 정상 기능을 회복했다고 밝혔다.
FDA는 임상2b상(STORM, NCT02336815) Part2 결과를 승인의 근거로 제시했다. STORM 연구는 Part1과 Part2로 나누어 진행했다. Part1은 4차 또는 5차 치료를 받았지만 치료되지 않은 다발성 골수종 환자를 대상으로 진행했으며, Part2는 5차 치료를 받았지만 치료되지 않은 다발성 골수종 환자를 대상으로 진행했다.
STORM Part2 연구에는 총 122명이 참여했다. 그 중 83명은 프로테아좀 억제제 ‘보르테조밉(bortezomib)’, ‘카르필조밉(carfilzomib)’, 면역조절 이미드 치료제 ‘레날리도마이드(lenalidomide)’, ‘포말리도마이드(pomalidomide)’, CD38 항체 ‘다라투무맙(daratumumab)’ 총 3가지 계열의 치료제를 투여받은 경험이 있다. 엑스포비오, 덱사메타손 병용투여는 질병이 진행되거나, 사망, 심한 독성이 발견될 때까지 진행했다.
STORM Part2 연구에서 3가지 계열의 치료제를 투여받은 경험이 있는 83명의 치료엑스포비오, 덱사메타손 병용요법 전체반응률(overall response rate, ORR)은 25.3%로 나타났다. 1명의 엄격한 완전관해(stringent complete response, sCR)를 확인했으며, 완전관해(complete response, CR)를 보인 환자는 없었다. 매우 좋은 부분관해(very good partial response, VGPR)는 4명, 부분관해(partial response, PR)는 16명으로 나타났다. 첫 반응까지 걸린 시간 중간값은 4주였으며, 반응지속기간(duration of response, DOR) 중간값은 3.8개월이었다.
STORM 연구에 참여한 총 202명의 환자 중 27%가 치료제 부작용으로 임상시험 참여를 중단했으며, 53%의 환자는 엑스포비오 용량을 줄여야 했다. 65.3%의 환자는 엑스포비오 투여를 중단하기도 했다. Grade3 이상의 중증 부작용이 발생한 환자 비율은 혈소판 감소증(thrombocytopenia) 61%, 호중구 감소증(neutropenia) 21%, 메스꺼움(nausea) 9%, 구토(vomiting) 4%, 설사(diarrhea) 6%, 거식증(anorexia) 5%, 체중감소 1%, 저나트륨증(Hyponatremia) 22%, 신경독성(neurological toxicity) 9%를 보였다. Grade 3 이상의 감염(infection) 증상을 보인 환자는 25%였다. Grade3 이상의 폐렴(pneumonia)은 9%, 패혈증(sepsis)은 6%의 환자에게서 나타났다. 감염증상이 나타난 환자 중 4%는 사망에 이르렀다. 캐리오팜은 사망환자에 대해 호중구 감소증과는 관련이 없었으며, 기회감염을 일으키는 병원체(opportunistic organism)는 아닌 것으로 확인했다고 밝혔다. 기회감염(opportunistic infection)은 건강한 사람에게 나타나지 않는 감염질환을 말하며, 수차례의 치료과정으로 면역기능이 약해진 삼중불응 다발성 골수종 환자는 기회감염을 일으킬 확률이 높다.
현재 캐리오팜은 엑스포비오, 덱사메타손 병용요법에 보르테조밉를 추가한 삼중병용 임상3상(BOSTON, NCT03110562)을 진행하고 있다. 엑스포비오의 효능을 확인하기 위해 진행하는 BOSTON 연구는 엑스포비오, 덱사메타손, 보르테조밉 삼중병용요법을 기존 치료법 중 하나인 덱사메타손, 보르테조밉 병용요법과 비교한다. 그리고 재발성, 불응성 미만성 거대 B세포 림프종(diffuse large B-cell lymphoma, DLBCL), 지방육종(liposarcoma), 재발성 신경교종(recurrent glioma), 자궁체부암(endometrial cancer) 등에 대해서도 임상시험을 진행하고 있다.







