기사본문
셀트리온, 램시마 'IBD 효능 입증' 3상 연구결과는
입력 2019-10-24 06:58 수정 2019-10-24 06:59
바이오스펙테이터 바르셀로나(스페인)=장종원 기자

"셀트리온 램시마가 출시 초기에는 염증성 장질환(Inflammatory bowel disease, IBD) 적응증에 처방해도 되느냐는 많은 질문을 받았다. 셀트리온은 램시마의 IBD 적응증과 관련한 다양한 임상 결과를 통해 그 답을 주고 우려를 지워왔다."
스페인 바르셀로나에서 열린 UEGW(United European Gastroenterology Week) 학회장에서 만난 이상준 셀트리온 임상개발본부 수석부사장의 말이다.
그는 22일(현지시간) UEGW 학회에 마련된 셀트리온헬스케어 전시부스에서 램시마가 오리지널의약품과의 비교임상을 통해 염증성 장질환(Inflammatory bowel disease, IBD) 적응증에 대한 유효성과 안전성을 입증한 'Planet CD' 연구결과를 소개했다.
램시마는 류마티스관절염과 강직성 척추염 환자를 대상으로 한 임상을 통해 허가를 받았고 적응증 외삽(Indication Extrapolation) 정책에 따라 80개국 이상에서 IBD(크론병, 궤양성 대장염) 질환에 처방되고 있다. 하지만 IBD내 비교 임상 없이 적응증을 인정하는 외삽 정책에 대한 일부의 우려가 있었고 셀트리온은 이를 해소하기 위해 이번 임상을 기획했다. 이번 연구는 허가 후 외삽된 적응증에 대해 세계 최초로 실시된 바이오시밀러와 오리지널의약품 간 임상 3상 결과라는 점에서 의미가 크다.
연구팀은 전세계 16개국서 크론병(Crohn’s disease, CD) 환자 220명을 무작위로 램시마 투여유지 군(56명, 5mg/kg), 오리지널의약품 투여유지 군(54명), 30주 시점 램시마에서 오리지널의약품으로 교체처방(switching)하는 군(55명), 30주 시점 오리지널의약품에서 램시마로 교체처방하는 군(55명) 등 네 군으로 나누어 54주의 치료 기간 동안 크론병 활성도 지수(CDAI), 임상적 관해율(clinical remission rate), 장 점막 치유(Mucosal healing) 등을 통해 투약효과 및 안전성을 비교 관찰했다.
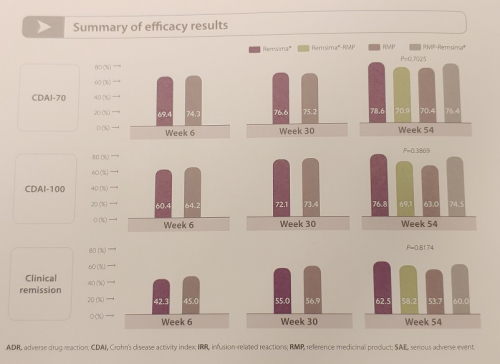
셀트리온은 최초 투약 6주 시점에 1차 충족점인 CDAI-70 반응률을 측정해 램시마와 오리지널의약품간의 비열등성을 확인했으며 30주 교체 처방을 통해 CAAI-70, CDAI-100, 임상적 관해율, 장 점막 치유 뿐 아니라 안전성 등에서 램시마와 오리지널의약품과 유사한 것을 확인했다.
이상준 부사장은 "1년간의 관찰을 통해 램사마의 크론병 환자 치료 효과, 안전성 등을 확보했다"면서 "이 결과가 IBD 임상의사들이 치료제를 선택하는 판단에 도움이 되길 기대한다"고 설명했다.
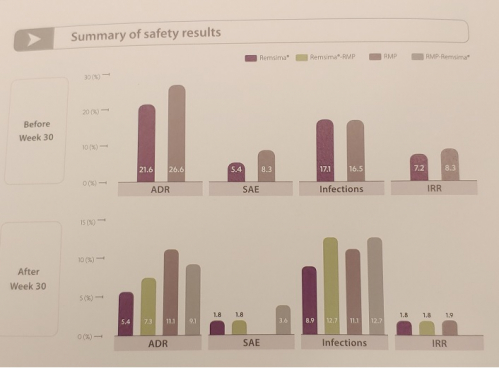
셀트리온 관계자는 "이번 연구는 램시마의 IBD질환 치료의 과학적 기반을 제공하는 중요한 데이터"라면서 "외삽된 적응증 및 교체처방에 대한 임상 데이터를 확보함으로써 타 바이오시밀러 제품들과는 차별화된 강점을 갖게 됐다"고 강조했다.
한편 셀트리온은 이외에도 램시마의 염증성장질환 환자 2813명에 대한 시판후 연구, 영국 총 1610명의 환자 대상 램시마, 휴미라 비교 'PANTS study', 램시마SC 적응증 확대를 위한 136명 환자 대상 램시마SC IBD 주요(pivotal) 임상 결과 등을 공개했다.





![[인사]삼양그룹, 정기 임원인사 및 조직개편](https://img.etoday.co.kr/crop/268/200/2248394.jpg)


