기사본문
[남궁석의 신약연구史]HCV 완치 '소발디' 나오기까지
입력 2019-12-12 13:40 수정 2019-12-12 14:19
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
1989년 C형 간염 바이러스가 발견된 이후, 백신이 개발되어 예방이 가능해졌던 다른 간염 바이러스와는 달리 C형 간염 바이러스는 백신 개발이 극히 어렵다는 것이 판명되었고, C형 간염 바이러스 감염자에 대해서는 이를 치료하는 항 바이러스 요법의 개발하려는 노력이 이어졌다. 지금까지 12회 동안 연재된 ‘바이러스와의 전쟁’ 시리즈를 마감하는 이번 연재에서는 그동안 어떤 C형 간염 바이러스 치료제가 개발되었고, 단기간의 복용으로 C형 간염 바이러스를 거의 완치시킬 수 있는 ‘소발디’(Sovaldi)와 같은 치료제는 어떻게 개발되게 되었는지의 과정을 알아보도록 한다.
1세대 C형 간염 치료제 : 인터페론-알파(interferon-alpha, IFN-α)와 리바비린(ribavirin)
사이토카인의 일종으로서 면역계를 활성화시키는 인터페론-알파(IFN-α)에 대해서는 이전에 연재에서 발견 과정을 다룬바 있다[1]. 인터페론 등의 사이토카인을 이용하여 면역력을 활성화하여 항암 효과를 얻고자 하는 당초의 기대는 충족되지 않았지만, 간염 등의 바이러스성 질병에 대해서는 어느 정도의 치료효과를 가진다는 것이 발견되었다. 아직 C형 간염 바이러스가 발견되지 않았고, 이 질병이’Non-A/Non-B 간염’ 으로 불리던 1986년에 이미 환자 대상으로 재조합 인터페론 알파를 이용하여 간염 증상의 완화를 가져온다는 것이 알려졌다[2]. 그러나 인터페론을 이용한 치료는 간염 증상을 일시적으로 완화시키기는 했지만 C형 간염을 완치시키지는 못했다. 가령 24주 동안 매일 3회 알파 인터페론을 투약받은 환자 중 혈액에서 바이러스가 완전히 없어지는 비율(지속적 바이러스 반응, sustained virologic response, SVR : 치료가 끝난 후 24 주 동안 혈액에서 바이러스가 발견되지 않는 상태)은 6% 에 불과했다[3].
이와는 별도로 바이러스의 RNA 중합효소를 저해하는 핵산 유사체(Nucleotide analogs)인 리바비린(Ribavirin)을 이용하여 HCV 환자를 치료하려는 시도도 진행되었다. 리바비린은 1971년에 발견된 항바이러스의 물질로서, 원래 라우스 사코마 바이러스(Rous sarcoma virus, RSV)의 역전사효소를 저해하는 물질을 찾으려는 과정에서 발굴되었다[4]. 이전의 신약연구사 연재에서도 다루었지만, 1970년대에 암이 레트로바이러스에 의해서 주로 일어난다고 생각할 때, 항암제로서 활성을 가지는 항 바이러스 물질을 찾는 과정에서 많은 항바이러스 물질들이 발굴되었고, 리바비린도 그 중의 하나였다. 1996년 리바비린을 단독으로 HCV 감염 환자에게 투여해 본 결과 간 수치가 개선되는 등의 효과는 보였지만 바이러스의 수준을 낮추지는 못했다[5]
그러나 1998년 리바비린과 인터페론-알파를 병용하여 치료에 사용해 본 결과 24주 투여후 바이러스가 혈액에서 완전히 없어지는 SVR 반응을 보인 환자의 비율은 34~42%로 크게 높아졌다[6]. 이것은 바이러스 RNA 중합효소 저해제인 리바비린과 면역력을 활성화하는 사이토카인인 인터페론 알파가 단독으로는 큰 효과를 보이지 않지만 이를 병용하면 매우 높은 상승작용을 일으킨다는 의미였다. 이 보고 이후 리바비린과 인터페론을 병용하는 치료가 HCV 감염자에 대한 표준적인 치료법으로 사용되기 시작하였다.
그 다음 이루어진 개선은 인터페론 알파의 약동학적인 성질을 개선함으로써 이루어졌다. 인터페론 알파는 단백질 의약품으로서, 주사 이후 혈액 내에서 단백질 분해효소에 의해서 신속히 분해되거나 신장에서 소변을 통하여 배출되어, 지속적인 효과를 내기는 어려웠다. 그러나 인터페론-알파에 고분자 물질인 폴리에틸린 글리콜(Polyethylene glycol)을 붙이는 페길레이션(PEGylation) 기술이 개발되면서 혈액 중의 반감기가 길어지게 되었고, 이와 더불어 면역원성을 감소시키는 효과를 얻게 되었다. 페길레이션된 인터페론-알파(페그인터페론)의 경우 단독으로 48주 동안 투여했을때 39%의 환자에서 바이러스가 검출되지 않았고, 리바비린과 같이 사용되었을때는 그 비율이 54~56%로 높아졌다[7]..
인터페론과 리바비린을 이용한 치료법은 HCV에 감염된 상당수의 환자에서 효과를 나타내기는 했지만 여러가지 단점을 가지고 있었다. 빈혈, 독감 유사 증상, 정신적 장애 등과 같은 부작용이 보고되었으며 일단 절반 이상의 환자들은 치료를 받아도 바이러스가 완전히 근절되지 않는다는 한계를 가지고 있었다.
그러나 이러한 한계는 2010년대에 들어서 등장한 신세대 HCV 치료제에 의해 극복되게 된다.
신세대 C형 간염 치료제의 등장
이전 연재에서 설명했듯이 HCV의 단백질은 일단 한 가닥의 단백질로 번역된 다음, 바이러스 내의 단백질 분해효소 활성을 가진 단백질인 NS3에 의해서 잘려서 단백질로 기능하게 된다. HIV의 치료제로 HIV의 단백질 분해효소를 저해하는 물질들이 HIV 감염 치료에 크게 기여한 것처럼 HCV의 단백질 분해효소인 NS3을 저해하는 것과 같이 바이러스 단백질에 직접 작용하는(Direct-act antivirals, DAAs) 계열의 항바이러스 제제의 개발이 진행되었다. 2011년 최초의 경구 투여 HCV 치료제인 보세프레비르(Boceprevir)와 텔라프레비르(Telaprevir)가 FDA의 승인을 받았다. 이들과 기존의 리바비린/페그인터페론을 병용함으로써 치료후 바이러스가 검출되지 않는 완치 비율은 70% 정도로 올라갔다. 그러나 이들 1세대 DAA는 하루에 3번 투여해야 하며 여러가지 부작용이 있는 한계를 가지고 있었다 [8].
그러나 2013년 2세대 DAA의 출현은 C형 간염 치료의 혁신을 가져온다. 단백질 분해효소 저해제인 시메프레비르(상품명 올리시오, 존슨 & 존슨)와 HCV의 RNA 중합효소인 NS5B 저해제인 길리아드의 소포스루비르(상품명 소발디, 길리아드)는 리바비린/페그인터페론을 12주 간 병용하여 치료하면 90%의 환자에게서 바이러스가 검출되지 않았다. 그 이후 경구 복용이 가능한 단백질 분해효소 저해제인 시메프레비르와 RNA 중합효소 저해제인 소포스루비르를 병용함으로써 거의 100%에 가까운 완치가 가능하게 되었다[9-10].
소포스루비루는 기존에 사용하던 약제인 리바비린과 마찬가지로 RNA 중합효소를 경쟁적으로 저해하는 약물이다. 그러나 리바비린에 비해서 월등히 좋은 효능을 가지고 있다. 그 이유는 무엇일까? 뉴클레오사이드 유사체의 경우 세포 내에서 RNA 중합효소를 억제하기 위해서는 세포 내의 뉴클레오사이드 인산화효소에 의해서 인산화가 이루어져야 하며, 이 과정은 상당히 시간이 걸리므로 세포 내에서 실제로 유효하게 작동하는 저해 물질의 농도는 높지 않다. 뉴클레오사이드에 미리 인산화를 한 뉴클레오타이드(Nucleotide)의 경우 인산기 때문에 세포 내로의 투과성이 낮아지므로 약물로서의 효용이 떨어진다.
소포스루비르는 이러한 문제점을 극복하기 위한 프로타이드(ProTide)라는 전략을 통하여 디자인된 약물이다[11]. 소포스루비르는 뉴클레오사이드에 하나의 인산기가 결합되어 있기 때문에 뉴클레오사이드 인산화효소에 의해서 인산화될 필요가 없다. 그러나 소포스루비르의 인산기에는 페닐기 등의 블로킹 그룹(Blocking Group)이 결합되어 있는 프로드럭(Prodrug) 형태로 되어 있기 때문에, 인산기의 음성 전하는 중화되고, 간세포 내로 쉽게 흡수되게 된다. 프로드럭 형태로 간 세포 내로 들어간 소포스루비르는 간세포 내에서 분해되어 뉴클레오타이드 일인산 형태의 중간체가 되고, 이 뉴클레오타이드 일인산은 추가로 2개의 인산기와 결합하여 실제로 RNA중합효소를 저해할 수 있는 활성물질로 변하여 RNA 중합효소를 저해하게 된다.
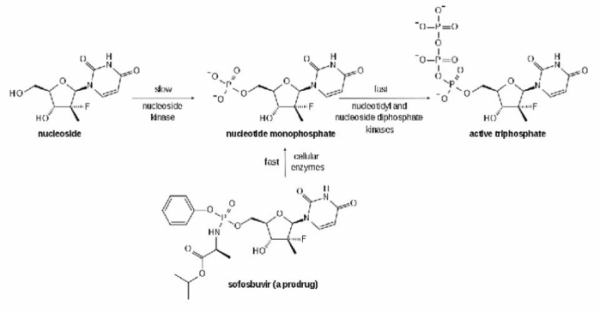
▲그림 : 소포스루브루 (상품명 : 소발디) 의 작용 기전. 소포스루비루는 핵산 유도체로써 인산기의 마이너스기를 중화하기 위하여 페닐기 등으로 인산기가 결합되어 있는 프로드럭 (Prodrug) 이다. 간세포로 흡수된 다음 인산기에 결합되어 있는 부분이 세포 내의 효소에 의해서 제거되고 인산화되어 바이러스의 RNA 중합효소를 저해하는 활성 형태로 변화한다. 인산화가 되지 않아서 세포 내에서 인산화되는데 오래 걸리는 뉴클레오사이드 (nucleoside)형태의 저해물질에 비해서 훨씬 빨리 활성물질로 변한다는 장점을 가지고 있다.
이렇게 소포스루비루(상품명 소발디)와 HCV 복제에 필요한 다른 단백질인 NS5A 저해물질인 레디파스비르(Ledipasvir)의 복합제인 하보니(Harvoni)의 등장에 의해서 경구 투여 항바이러스 제제의 복용만으로 거의 100%에 가까운 환자에서 HCV 바이러스가 검출되지 않는 완치 수준으로 치료가 가능하게 되었다. 미국에서 2016년 기준으로 12주의 소발디의 복용에 드는 비용은 약 8만4,000달러에 달한다. 이렇게 높은 비용은 저소득층이 치료를 받는데 장벽으로 작용하는 문제로 작용했다. 문제는 신약 개발에 소요되는 비용은 다른 약물과 유사한 수준으로 높은 데 반하여, 소발디와 같은 새로운 HCV 치료제는 효능이 너무 좋은 관계로 12주 치료로 HCV 감염자가 완치된 이후에는 더이상 복용을 할 필요가 없기 때문에 평생 동안 복용을 해야 하는 항 HIV 약제와는 다른 상황이다.
이러한 상황은 치료제를 개발한 제약회사와 보건 당국에 여러가지 고민거리를 가져오게 되었다. 제약회사로서는 단기간의 치료로 완치되는 질병 치료제라면 높은 개발비를 보전하기 위하여 높은 가격을 책정하고 싶을 것이다. 그러나 이러한 높은 가격은 보건당국과 의료보험, 그리고 저소득층 환자들에게는 큰 부담으로 작용한다. 이러한 서로 상이한 이해관계를 만족시키기 위해서는 적절한 지점에서의 타협점이 등장해야만 할 것이다.
어쨌든 2010년대에 등장한 경구 투여 항바이러스 제제의 등장은 기존에 난치병으로 여겨지던 C형 간염을 충분히 완치가 가능한 질병으로 바꾸었다는 점에서 C형 간염의 치료에서 획기적 전기를 마련하였으며, 만성 바이러스성 질병의 환자를 항바이러스제를 통하여 완치할 수 있는 가능성을 보여줬다는 점에서 큰 의의가 있다 하겠다.
이것으로 지난 12회 동안 연재된 ‘바이러스와의 전쟁’역사에 대한 연재를 마치고 다음 연재부터는 새로운 질병에 대한 약물의 개발 역사에 대해서 알아보도록 한다.
참고문헌
남궁석, 사이토카인의 발견, 부활하기까지, http://www.biospectator.com/view/news_view.php?varAtcId=5325
Hoofnagle JH, Mullen KD, Jones DB, Rustgi V, Di Bisceglie A, Peters M, et al. Treatment of chronic non‐A, non‐B hepatitis with recombinant human alpha interferon. N Engl J Med 1986; 315: 1575–1578.
Davis GL, Balart L, Schiff E, Lindsay K, Bodenheimer HC Jr, Perrillo RP, et al. Treatment of chronic hepatitis C with recombinant interferon alfa. A multicenter randomized, controlled trial. Hepatitis Intervention Therapy Group. N Engl J Med 1989; 321: 1501–1506.
Snell, N. J. (2001). Ribavirin-current status of a broad spectrum antiviral agent. Expert opinion on pharmacotherapy, 2(8), 1317-1324.
Dusheiko G, Main J, Thomas H, Reichard O, Lee C, Dillon A, et al. Ribavirin treatment for patients with chronic hepatitis C: results of a placebo‐controlled trial. J Hepatol 1996; 25: 591–598.
McHutchison JG, Gordon SC, Schiff ER, Shiffman ML, Lee WM, Rustgi VK, et al. Interferon alfa‐2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group. N Engl J Med 1998; 339: 1485–1492.
Reddy RK, Wright TL, Pockros PJ, Shiffman M, Everson G, Reindollar R, et al. Efficacy and safety of pegylated (40‐kd) interferon alpha‐2a compared with interferon apha‐2a in noncirrhotic patients with chronic hepatitis C. Hepatology 2001; 33: 433–438.
Kish, T., Aziz, A., & Sorio, M. (2017). Hepatitis C in a new era: a review of current therapies. Pharmacy and Therapeutics, 42(5), 316.
Childs-Kean LM, Hand EO (February 2015). "Simeprevir and sofosbuvir for treatment of chronic hepatitis C infection". Clinical Therapeutics. 37 (2): 243–67
Smith MA, Chan J, Mohammad RA (March 2015). "Ledipasvir-sofosbuvir: interferon-/ribavirin-free regimen for chronic hepatitis C virus infection". The Annals of Pharmacotherapy. 49 (3): 343–50. doi:10.1177/1060028014563952
Cahard, D. (2004). Aryloxy Phosphoramidate Triesters as Pro-Tides. Mini Reviews in Medicinal Chemistry, 4(4). doi:10.2174/1389557043403936







