기사본문
일동제약, '新기전 편두통신약' 가교 3상 "모집 완료”
입력 2020-09-28 11:16 수정 2020-09-28 11:16
바이오스펙테이터 서윤석 기자

일동제약이 새로운 기전의 편두통 치료제 ‘레이보우(Reyvow, lasmiditan)’ 출시를 위한 가교 임상3상을 진행한다. 내년 상반기 임상을 마치고, 오는 2022년 출시가 목표다.
'레이보우'는 일라이 릴리(Eli Lilly)가 개발해 지난해 10월 미국 식품의약국(FDA)에서 승인받은 새로운 기전의 급성 편두통 치료제다. 일동제약은 국내를 포함해 아세안 8개국의 레이보우 판권을 가지고 있다. 28일 업계에 따르면 일동제약이 최근 급성 편두통 치료제인 5-HT1F 작용제 ‘레이보우’의 가교임상 3상 환자등록을 완료했다.
일동제약은 지난해 12월 식품의약품안전처로부터 가교임상 3상을 승인받고 서울대병원, 건국대병원, 고려대병원, 아산병원 등 13개 기관에서 환자를 모집해왔다. 일반적으로 가교임상은 수십명 단위로 진행되지만 이번 가교임상은 288명에 달하는 대규모 임상이다. 가교임상은 해외에서 약효가 검증된 약물을 국내에서 승인받기 위해 진행하는 임상을 말한다.
일동제약은 내년 상반기까지 가교임상 3상을 마무리하고 신약허가신청(NDA)를 한다는 계획으로 2022년 출시를 목표로 하고 있다.
◆레이보우 임상 결과..”2시간내 편두통 제거 및 48시간 효과지속”
레이보우는 세로토닌 수용체중 하나인 ‘5-HT1F’에 선택적으로 결합하는 세로토닌 수용체 작용제다. 전조증상(aura) 유무에 상관없이 급성 편두통 환자의 통증과 증상을 2시간내에 완화시키는 치료제로 지난해 FDA의 승인을 받았다. 세로토닌(5-HT)1F 수용체에 작용하는 치료제로는 최초이자 유일하다. 기존의 편두통 약물로 개발된 다양한 트립탄(Triptan) 제제는 ‘5-HT1B’ 및 ‘5-HT1D’ 수용체에 결합해 신경성 염증반응을 억제한다.
일라이 릴리는 Samurai(NCT02439320)와 Spartan(NCT02605174) 임상 3상에서 레이보우로 치료받은 환자들이 2시간 내 통증이 사라지고 빛, 소리, 오심에 과민반응을 나타내는 MBS(most bothersome symptom) 증상이 위약보다 개선되는(p<0.05) 결과를 지난해 밝혔다.
추가로 릴리는 추가 임상 3상(Centrurion study, NCT03670810)에서 2시간내 통증해소 효과와 통증해소 효과가 48시간 동안 유의미하게 지속되는 결과를 지난 14일 밝힌바 있다. 편두통 환자 1471명을 위약군(500명), 레이보우 100mg(485명), 레이보우 200mg(486명)의 3그룹으로 나눠 임상을 진행한 결과다.
구체적으로 릴리는 레이보우로 치료받은 환자군에서 2시간내 통증해소 비율이 25%이상(vs 8.4%, p<0.001)으로 위약보다 3배이상 높았다고 설명했다. 특히 레이보우 200mg으로 치료받은 환자는 1시간내 통증해소확률이 12.7%(vs 2.0%, p<0.001)로 위약보다 높았다. 또, 릴리는 레이보우로 치료받은 환자들이 통증해소 효과가 24~48시간동안 지속된 결과를 보였다.
한편 시장조사기관 이벨류에이트파마는 2024년까지 레이보우의 약 3억1700만달러의 매출을 올릴 것으로 예측했다.
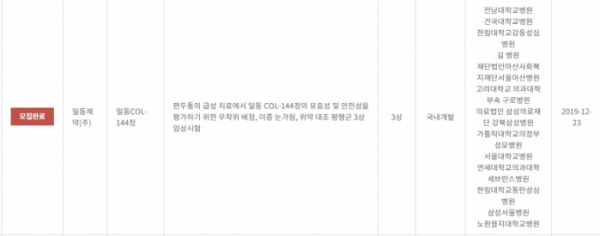
▲일동제약 레이보우 가교임상 3상 환자모집 완료(식약처 홈페이지 참조)







