기사본문
삼성바이오, 휴미라 바이오시밀러 '임랄디' 유럽 판매허가
입력 2017-08-25 08:01 수정 2017-08-25 08:43
바이오스펙테이터 장종원 기자
삼성바이오에피스의 자가면역질환 치료제(Anti TNF-α) 바이오시밀러 임랄디(Imraldi®, 성분명: 아달리무맙, 프로젝트명: SB5)가 유럽 판매허가를 받았다. 연 매출 18조원을 상회하는 전세계 판매 1위 바이오의약품 휴미라의 바이오시밀러 제품이다.
삼성바이오에피스는 25일 임랄디가 유럽연합 집행위원회(European Commission)로부터 판매허가를 받았다고 밝혔다. 지난해 7월 EMA에 승인신청을 한지 1년 1개월, 지난 6월 판매허가에 결정적인 역할을 하는 EMA 산하 약물사용자문위원회의 승인 권고를 받은지 2개월만이다.
이에 따라 유럽 관문을 넘은 삼성바이오에피스의 바이오시밀러 파이프라인은 베네팔리(성분명: 에타너셉트, 엔브렐 바이오시밀러)와 플릭사비(성분명: 인플릭시맙, 레미케이드 바이오시밀러), 루수두나(성분명: 인슐린글라진, 란투스 바이오시밀러)에 이어 임랄디까지 총 4종으로 늘어나게 됐다. 허셉틴 바이오시밀러(프로젝트명: SB3, 성분명: 트라스투주맙)는 지난해 10월 허가신청해 EMA 심사 중에 있다.
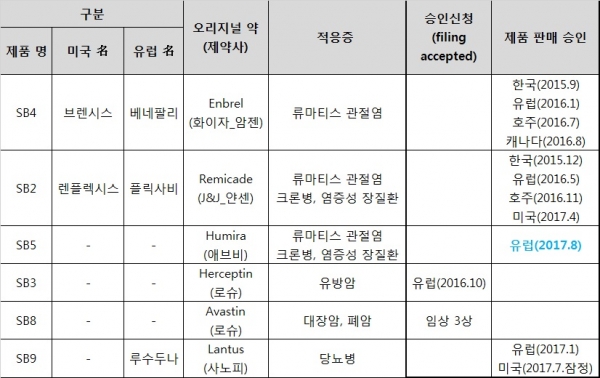
임랄디는 유럽 특허가 만료되는 2018년 하반기 유럽 파트너사인 바이오젠에 의해 시장에 출시될 전망이다. 지난 3월 영국 고등법원이 애브비가 등록한 휴미라 용도 특허(류마티스 관절염과 건선 적응증에 대한 투여방법 특허)에 대해 특허성이 없다고 판결하는 등 특허장막이 걷히고 있다. 삼성은 임랄디의 국내(지난해 6월 판매허가 신청) 및 미국 시장(판매허가 신청 예정) 진출도 계획하고 있다.
류머티스 관절염, 궤양성 대장염, 크론병, 강직성 척추염, 건선 등에 적응증을 갖는 미국 애브비(AbbVie)의 항체의약품 휴미라는 전세계 판매 1위 바이오의약품이다. 시장조사기관 이벨류에이트파마(Evaluatepharma)에 따르면 휴미라의 지난해 매출은 165억달러(18조 6000억원). 바이오시밀러 공세가 이어진 2022년에도 연매출이 159억 달러에 이를 것으로 전망했다.
이에 따라 바이오시밀러 개발 경쟁도 뜨거운데 삼성바이오에피스 임랄디에 앞서 암젠의 ‘암제비타’(Amgevita)가 지난해 9월 미국, 올해 3월 유럽에서 먼저 허가를 받았다. 여기에 노바티스 자회사인 산도즈와 일본계인 후지필름 쿄와키린 바이오로직스가 지난 5월 각각 'GP2017'과 'FKB327'의 유럽 허가를 EMA에 신청했다. 앞서 베링거인겔하임 역시 지난 1월 'BI695501' 허가를 요청했다. 애브비가 2022년까지 특허 연장에 성공한 미국시장의 경쟁은 더 치열할 전망이다.







