기사본문
사이토키네틱스, ALS 치료제 ‘Reldesemtiv’ 2상 실패
입력 2019-05-08 06:36 수정 2019-05-08 06:51
바이오스펙테이터 서일 기자

미국 사이토키네틱스(Cytokinetics)는 필라델피아에서 열린 AAN 2019(The 2019 Annual Meeting of American Academy of Neurology)에서 ALS 치료제 ‘Reldesemtiv’ 임상 2상(FORTITUDE-ALS, NCT03160898)에서 1차 종결점인 SVC(Slow Vital Capacity) 개선에 실패했다고 지난 5일(현지 시간) 발표했다.
루게릭병으로도 불리는 진행성 신경퇴행성 질환인 ALS는 미국에만 2만여 명의 환자가 있으며, 미국에서 매년 5000여명이 ALS 진단을 받는 것으로 알려졌다.
미쓰비시 다나베 파마(Mitsubishi Tanabe Pharma)의 ALS 치료제 ‘Radicava(성분명 Edaravone)’는 미국 식품의약국(FDA)으로부터 2017년 5월 승인을 받았다. 정확한 기전은 밝혀지지 않았지만, 항산화 물질인 ‘Radicava’는 신경의 산화스트레스를 줄이는 것으로 알려졌다. 24주간 진행된 ALS 환자 대상 임상 3상(NCT01492686)에서 ‘Radicava’는 ALSFRS-R 기준 증상 악화가 위약 그룹보다 33% 느려진 것으로 확인됐다.
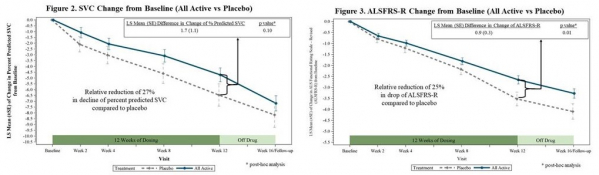
▲‘Reldesemtiv’ 투여 그룹, 위약 그룹 비교(AAN 2019 사이토키네틱스 발표자료)
사이토키네틱스는 12주간 ‘Reldesemtiv’ 150mg, 300mg, 450mg을 투여한 ALS 환자 대상 임상 2상에서 증상을 멈추거나 개선하지는 못했지만, 위약그룹보다 병의 진행이 느려진 점은 의미가 있다고 밝혔다. ‘Reldesemtiv’ 투여그룹은 호흡 기능을 확인하기 위한 SVC 측정에서 증상 악화가 위약그룹보다 27% 느려진 것으로 나타났으며, 2차 종결점인 ALSFRS-R(the ALS Functional Rating Scale-Revised) 기준 증상 악화가 위약그룹보다 25% 느려진 것으로 나타났다. 임상시험 초기에 참여를 포기한 환자는 위약그룹과 유사한 수준으로 질병 진행이 빨라졌다. 부작용으로 피로감, 구역질, 두통이 발생했다. eGFR(estimated Glomerular Filtration Rate) 검사에서 위약그룹의 2%에서 신장 기능 바이오마커인 시스타틴 C(Cystatin C)가 증가했지만, ‘Reldesemtiv’ 투여그룹의 7%(150mg), 8%(300mg), 17%(450mg)에서 시스타틴 C가 증가한 것으로 확인됐다.
사이토키네틱스의 ‘Reldesemtiv’는 ‘Radicava’와 다르게 신경을 표적하지 않는다. ‘Reldesemtiv’는 FSTA(Fast Skeletal Muscle Troponin Activator) 약물로, 근절(Sarcomere)의 트로포닌 C(Troponin C)에 결합한다. FSTA 약물과 결합한 트로포닌은 근육이 수축한 이후 방출되는 칼슘양이 줄어든다. 상대적으로 높은 농도의 칼슘으로 근육 세포의 민감도가 증가하면서, 신경 신호가 약해지더라도 근육수축의 강도가 유지된다.
Fady Ibraham Malik 사이토키네틱스 부사장은 “FORTITUDE-ALS 연구가 1차 종결점을 충족하지 못했지만, ALS 환자 치료에서 골격근을 활성화할 수 있는 잠재력을 입증한 것은 고무적”이라고 밝혔다.
사이토키네틱스는 FSTA 약물을 ALS만이 아니라, SMA(Spinal Muscular Atrophy)를 포함하여 근육 약화, 피로 등을 유발하는 근골격계 질환에 사용할 계획이다. FSTA 기전을 이용한 치료제를 출시하여, 신경근접합부가 줄어들거나 근육량이 감소하여 근육의 움직임에 문제가 생긴 환자의 운동기능을 개선할 수 있을 것으로 내다봤다.
사이토키네틱스는 일본 아스테라스 파마(Astellas Pharma)와 근육치료제 공동개발을 위한 계약을 맺은 바 있다. 아스테라스 파마는 2013년 사이토키네틱스의 FSTA 약물인 ‘Tirasemtiv’, ‘CK-2127107(Reldesemtiv)’의 독점권을 획득하기 위한 4억9000만달러 규모의 계약을 맺었다. 아스테라스 파마는 2016년 옵션 행사로 6500만달러를 추가 지급했지만, 2017년 ‘Tirasemtiv’ 임상 3상에서 폐 기능을 개선하지 못한 것으로 확인되면서 개발을 중단했다. 이후 사이토키네틱스는 ‘Reldsemtiv’의 내약성, 효능이 ‘Tirasemtiv’보다 뛰어날 것으로 예상하고 임상시험을 진행했다.







