기사본문
中베이진, '브루킨사' 희귀혈액암 3상서 "1차종결점 미충족"
입력 2019-12-18 07:10 수정 2019-12-18 07:24
바이오스펙테이터 봉나은 기자

중국 베이진(BeiGene)이 희귀 혈액암 환자에게 BTK 저해제 ‘브루킨사(Brukinsa, 성분명: zanubrutinib)'의 임상3상에서 1차 종결점 충족에 실패했다. 브루킨사는 지난 11월 미국 식품의약국(FDA)으ㄹ로부터 재발성/불응성 외투세포 림프종(MCL) 환자 치료제로 승인받은 치료제다. 베이진의 미국 FDA 첫 신약승인이었다.
베이진은 비호지킨 림프종 중에서도 희귀 혈액암 유형인 발덴스트룀 거대글로불린혈증(Waldenstrom’s macroglobulinemia, WM)의 치료제로 ‘브루킨사’와 얀센(J&J)의 ‘임브루비카(Imbruvica, 성분명: ibrutinib)’를 직접 비교하는 ASPEN 임상3상(NCT03053440) 결과를 16일(현지시간) 발표했다.
브루킨사는 임상에서 임브루비카 대비 안전성 및 내약성을 개선하고 매우 좋은 부분반응(Very good partial response, VGPR)을 유도했지만, 통계적으로 유의미한 결과를 도출하지 못했다.
ASPEN 임상은 WM 환자를 대상으로 브루킨사의 효능을 평가하는 2개 임상3상 중 하나로, 기존 진행성 혈액암 치료제인 ‘임브루비카’와 비교해 브루킨사의 우수성을 증명하는 것을 목표로 진행됐다. 임상은 2017년 1월부터 미국, 유럽, 호주 등의 61개 임상기관에서 수행됐다. 임상에 등록된 WM 환자 229명은 2개 코호트(코호트 1: MYD88 변이가 있는 환자 201명, 코호트 2: MYD88 정상형 환자 28명)로 나뉘어 치료받았다. 코호트 1에 등록된 102명(재발성/불응성 환자 83명, 치료경험이 없는 환자 19명)은 브루킨사 60mg을 1일 2회 경구 투약했으며, 99명(재발성/불응성 환자 81명, 치료경험이 없는 환자 18명)은 임브루비카 420mg을 1일 1회 경구 투약했다.
베이진이 이번에 공개한 임상 결과는 코호트 1의 지난 8월 31일까지의 데이터 컷 오프(data cut-off) 결과다.
19.4개월(중간값)의 추적 관찰기간 동안 재발성/불응성 환자집단에서의 VGPR은 브루킨사 치료군이 28.9%(24/83명), 임브루비카 치료군이 19.8%(16/81명)로 개선된 결과를 보였으나, 통계적으로 유의미하지 않았다(p=0.1160). 전체 환자집단에서의 VGPR도 브루킨사 치료군이 28.4%(29/102명), 임브루비카 치료군이 19.2%(19/99명)였으나, 통계적으로 유의미하지 않았다(p=0.0921).
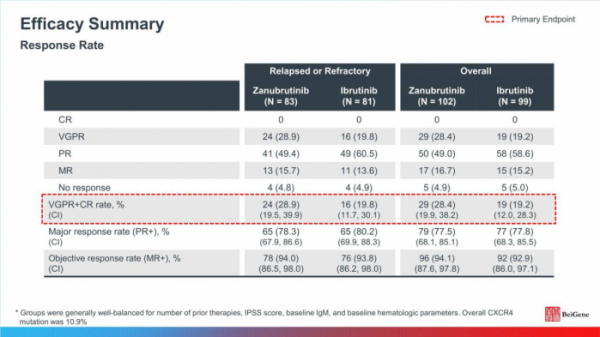
▲ASPEN 임상3상 결과
베이진은 이러한 결과에도 브루킨사와 임브루비카 치료군의 무진행생존기간(PFS)과 전체생존율(OS) 결과를 공개했다. 다만 베이진은 무진행생존기간(PFS)을 평가하기에 관찰 기간이 짧았다고 설명했다. 무진행생존기간(PFS)이 12개월에 도달한 환자는 재발성/불응성 환자집단에서 브루킨사 치료군의 92.4%(중간값), 임브루비카 치료군의 85.9%(중간값)였으며, 전체 환자집단에서는 각각 89.7%(중간값), 87.2%(중간값)였다.
안전성 프로파일도 브루킨사가 임브루비카보다 개선된 결과를 보였다. 3등급 이상의 이상반응은 브루킨사 치료군에서 58.4%, 임브루비카 치료군에서 63.3%로 확인됐다. 또한 불규칙한 심장박동이나, 이상반응으로 치료를 중단한 환자가 브루킨사 치료군에서 임브루비카 치료군 대비 적게 나타났다(4명 vs 9명).
BTK 저해제 치료에서 주로 나타나는 이상반응으로 심장조동/세동(fibrillation/flutter)이 각각 치료군에서 2%, 15.3%, 소출혈(minor bleeding)이 48.5%, 59.2%, 주요 출혈(major hemorrhage)이 5.9%, 9.2%, 설사가 20.8%, 31.6%로 관찰됐다.
베이진은 장기적으로 무진행생존기간(PFS)과 전체생존율(OS) 결과를 관찰하고, 2020년 1분기 미국 FDA, 유럽 EMA와 이번 결과에 대한 협의를 진행할 계획이다. 판매허가 승인을 위한 자료 제출 계획은 발표하지 않았다.
베이진은 향후 브루킨사 개발에 대한 계획도 발표했다. 만성 림프구성 백혈병(CLL), 변연부 림프종(MZL), 여포성 림프종(FL) 환자를 대상으로 한 임상도 진행하고 있다. 특히 임브루비카와 직접 비교하는 임상은 CLL 환자를 대상으로도 진행 중이며, 2020년 1분기에 결과를 발표할 예정이다. 이에 베이진은 2020년 상반기 재발성 불응성 CLL 치료제로 중국에서의 승인 절차를 기대하고 있다고 덧붙였다.







